목차
1. 실험방법
2. 실험결과
3. 실험토의
2. 실험결과
3. 실험토의
본문내용
2(㎖/㏖)
58.70
58.62
58.45
58.09
Table 6. - 실험2
구분
0.1875M
0.375M
0.75M
1.5M
V1(㎖/㏖)
18.13
18.00
18.16
18.12
V2(㎖/㏖)
57.67
58.05
58.23
58.32
<실험1>
<실험2>
3. 실험토의
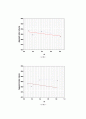
이번 실험의 목적은 NaCl의 몰분율에 따른 분몰부피를 구함으로써 분몰성질에 대하여 이해하는 것이다. 이론상 NaCl의 몰랄농도가 증가할수록 NaCl 용액의 겉보기 몰부피와 분몰부피는 모두 감소하여야 한다. 왜냐하면, 물과 NaCl이 섞이면서, NaCl 분자들 사이에 보다 작은 물 분자가 들어가기 때문이다. 실험을 통해 겉보기 몰부피를 계산하고 그래프를 그려보았는데, 몰랄농도가 증가할수록 겉보기 몰부피가 linear하게 줄어드는 것이 아니라 감소했다가 다시 증가하는 경향을 보여주었고, 또한 분몰부피는 거의 일정한 값을 나타내었다. 먼저 이번 실험에 영향을 준 요인을 살펴보면, 비중계를 들수 있다. 겉보기 몰부피와 분몰부피를 구하는 계산과정이 매우 복잡하기 때문에 실험 data의 작은 오차가 후에 실험값에 많은 영향을 주게 되는데, 실험을 시작하기 전에 비중계안의 수분을 완전하게 제거해주지 못하여, 비어있는 비중계의 질량(We)이 실제보다 크게 측정되었고, 또한 NaCl 수용액을 피펫으로 50ml를 정확히 재서 비중계에 담으려고 하였으나, 실제로는 비중계에 50ml가 다 들어가지 않아 용액이 들어있는 비중계의 질량 (W)이 정확하게 측정되지 않았다. 각 비중계마다 모두 담지 못하고 남게된 수용액의 양이 제각기 다르고, 수분이 완전히 제거되지 않은 비중계의 질량또한 수분이 제거되지 못한 양이 모두 다르고 그것을 측정하지 못했기 때문에, 그것이 실험값의 증감에 어떤 영향을 주었는지 설명하기 힘들지만, 대체적으로 W가 실제보다 작게, We가 실제보다 크게 측정되었다고 하면, W-We, 즉 순수한 시료의 무게가 실제보다 크게 측정되었을 것이라 예상할수 있다. 따라서 용액의 밀도 d값도 커지게 되고, 그에 따라 다른 실험값에도 복합적으로 영향을 주어, 실험값의 경향을 예측하기 힘들게 하였다. 또한 다른 요인으로는 실험실의 온도를 들수있다. 이 실험에서 실험값을 계산할때, 순수한 물의 밀도를 1g/ml로 계산하였지만, 실제로 온도에 따라 용액의 밀도가 달라지기 때문에, 실험을 하면서 온도를 재거나, 온도를 일정하게 유지시켜주는 것이 필요하다.
58.70
58.62
58.45
58.09
Table 6. - 실험2
구분
0.1875M
0.375M
0.75M
1.5M
V1(㎖/㏖)
18.13
18.00
18.16
18.12
V2(㎖/㏖)
57.67
58.05
58.23
58.32
<실험1>
<실험2>
3. 실험토의
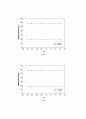
이번 실험의 목적은 NaCl의 몰분율에 따른 분몰부피를 구함으로써 분몰성질에 대하여 이해하는 것이다. 이론상 NaCl의 몰랄농도가 증가할수록 NaCl 용액의 겉보기 몰부피와 분몰부피는 모두 감소하여야 한다. 왜냐하면, 물과 NaCl이 섞이면서, NaCl 분자들 사이에 보다 작은 물 분자가 들어가기 때문이다. 실험을 통해 겉보기 몰부피를 계산하고 그래프를 그려보았는데, 몰랄농도가 증가할수록 겉보기 몰부피가 linear하게 줄어드는 것이 아니라 감소했다가 다시 증가하는 경향을 보여주었고, 또한 분몰부피는 거의 일정한 값을 나타내었다. 먼저 이번 실험에 영향을 준 요인을 살펴보면, 비중계를 들수 있다. 겉보기 몰부피와 분몰부피를 구하는 계산과정이 매우 복잡하기 때문에 실험 data의 작은 오차가 후에 실험값에 많은 영향을 주게 되는데, 실험을 시작하기 전에 비중계안의 수분을 완전하게 제거해주지 못하여, 비어있는 비중계의 질량(We)이 실제보다 크게 측정되었고, 또한 NaCl 수용액을 피펫으로 50ml를 정확히 재서 비중계에 담으려고 하였으나, 실제로는 비중계에 50ml가 다 들어가지 않아 용액이 들어있는 비중계의 질량 (W)이 정확하게 측정되지 않았다. 각 비중계마다 모두 담지 못하고 남게된 수용액의 양이 제각기 다르고, 수분이 완전히 제거되지 않은 비중계의 질량또한 수분이 제거되지 못한 양이 모두 다르고 그것을 측정하지 못했기 때문에, 그것이 실험값의 증감에 어떤 영향을 주었는지 설명하기 힘들지만, 대체적으로 W가 실제보다 작게, We가 실제보다 크게 측정되었다고 하면, W-We, 즉 순수한 시료의 무게가 실제보다 크게 측정되었을 것이라 예상할수 있다. 따라서 용액의 밀도 d값도 커지게 되고, 그에 따라 다른 실험값에도 복합적으로 영향을 주어, 실험값의 경향을 예측하기 힘들게 하였다. 또한 다른 요인으로는 실험실의 온도를 들수있다. 이 실험에서 실험값을 계산할때, 순수한 물의 밀도를 1g/ml로 계산하였지만, 실제로 온도에 따라 용액의 밀도가 달라지기 때문에, 실험을 하면서 온도를 재거나, 온도를 일정하게 유지시켜주는 것이 필요하다.

























소개글