목차
1.실험내용
2.ELISA reader or Microplate reader or Spectrophotometer
3.3.FACS
2.ELISA reader or Microplate reader or Spectrophotometer
3.3.FACS
본문내용
봉우리와 일치하는 파장(λmax)에서 이루어진다. 이 파장에서 분서물질의 주어진 농도에 대하여 가장 큰 감도-최대의 감응-를 나타낸다. 최대 흡광도를 나타내는 파장에서 스펙트럼은 거의 변하지 않기 때문에 파장이 변하거나 또는 단색화 장치에서 선택한 파장의 매우 한정된 띠나비에 기이하는 오차를 최소화시킬 수 있다.
스펙트럼 측정에서는 양쪽 Cuvet에 들어있는 순수한 용매, 또는 시약 바탕의 바탕선을 먼저 기록하는 것이 기본이다. 원칙적으로 바탕선의 흡광도는 영이다. 그러나 두 Cuvets의 짝맞추기를 약간 잘못하거나 기기적인 결함으로 인하여 약간의 양 또는 음의 바탕선 흡광도를 나타낸다. 그러므로 시료의 흡광도를 기록한 다음, 이것으로부터 바탕선의 흡광도를 보정해 주어야 한다.
먼지는 빛을 산란시킴으로써 마치 시료의 흡광도가 증가하는 것처럼 보인다. 따라서 모든 용기는 먼지가 끼어 들어가는 것을 막기 위해 반드시 뚜껑을 덮어야 한다. Cuvet은 빛이 통과하는 면에 지문이 묻지 않도록 하기 위하여 깨끗한 휴지로 다루어야 할 뿐만 아니라 사란을 일으킬 수 있는 표면의 오염을 피하기 위하여 매우 깨끗이 해야 한다.
분광광도법에서 시료와 기준 Cuvet의 짝짓기를 약간 잘못하면, 계통 오차를 일으킨다. 그리고 분광광도법에서 Cuvet을 가능한 한 재현성 있게 놓는 것이 중요하다. Cuvet Holder에 Cuvet을 약간 잘못 놓거나, 편평한 모양의 Cuvet을 180° 회전시키던지 또는 실린더형 Cuvet을 회전시키면, 이로 인하여 흡광도 측정에서 우연오차를 일으키게 된다.
3.FACS(우리조는 실험을 하지 않아서 다른조 레포트 참조했음)
-실험목적:성숙한 Tcell과 미성숙한 Tcell의 CD4와 CD8의 발현양상 비교.
-실험준비물:마우스,부검도구, petry dish, 주사기, centryfuge, flow cytometer, buffer,
antibody, tube, pipeete, FACScan.
-실험과정
i) 쥐를 해부하여 thymus와 mesenteric lymph node를 적출한다.
ii) 위의것을 각각 페트리디쉬에 담아서 single cell로 만든다.
iii) single cell을 각각 tube에 담아서 원심분리(1000rpm 5분) 시킨후 상층액을 제거한후 thymus는 5ml의 PBS를, lymphnode는 1ml의 PBS를 각각 넣고 섞어준 후에 FACS 전용튜브에 옮겨준다.
iv) 두 개의 튜브 모두 α-CD4 Ab-FITC와 α-CD8 Ab-PE를 넣어준다.
→FACS기계에서 레이져를 쐈을때 FL1이 FITC와 반응하여 녹색을 나타내고,
FL2는 PE와 반응하여 붉은색을 나타내서 이것을 가지고 결과를 낸다.
v)위의 두 튜브에 담긴 thymus와 lymphnode를 FACS기계에 넣고 작동시킨다.
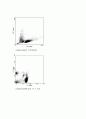
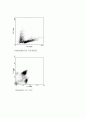
→FACS의 작동원리는 세포를 하나씩 흘려 보내면서 레이져(FL1,FL2,FSC,SSC)를
쏴서 세포의 크기, 과립밀도, FITS와PE의 밀도등을 알아낸다. 결과ㅑ에 나온 점
하나하나는 각각 세포 한 개다.
스펙트럼 측정에서는 양쪽 Cuvet에 들어있는 순수한 용매, 또는 시약 바탕의 바탕선을 먼저 기록하는 것이 기본이다. 원칙적으로 바탕선의 흡광도는 영이다. 그러나 두 Cuvets의 짝맞추기를 약간 잘못하거나 기기적인 결함으로 인하여 약간의 양 또는 음의 바탕선 흡광도를 나타낸다. 그러므로 시료의 흡광도를 기록한 다음, 이것으로부터 바탕선의 흡광도를 보정해 주어야 한다.
먼지는 빛을 산란시킴으로써 마치 시료의 흡광도가 증가하는 것처럼 보인다. 따라서 모든 용기는 먼지가 끼어 들어가는 것을 막기 위해 반드시 뚜껑을 덮어야 한다. Cuvet은 빛이 통과하는 면에 지문이 묻지 않도록 하기 위하여 깨끗한 휴지로 다루어야 할 뿐만 아니라 사란을 일으킬 수 있는 표면의 오염을 피하기 위하여 매우 깨끗이 해야 한다.
분광광도법에서 시료와 기준 Cuvet의 짝짓기를 약간 잘못하면, 계통 오차를 일으킨다. 그리고 분광광도법에서 Cuvet을 가능한 한 재현성 있게 놓는 것이 중요하다. Cuvet Holder에 Cuvet을 약간 잘못 놓거나, 편평한 모양의 Cuvet을 180° 회전시키던지 또는 실린더형 Cuvet을 회전시키면, 이로 인하여 흡광도 측정에서 우연오차를 일으키게 된다.
3.FACS(우리조는 실험을 하지 않아서 다른조 레포트 참조했음)
-실험목적:성숙한 Tcell과 미성숙한 Tcell의 CD4와 CD8의 발현양상 비교.
-실험준비물:마우스,부검도구, petry dish, 주사기, centryfuge, flow cytometer, buffer,
antibody, tube, pipeete, FACScan.
-실험과정
i) 쥐를 해부하여 thymus와 mesenteric lymph node를 적출한다.
ii) 위의것을 각각 페트리디쉬에 담아서 single cell로 만든다.
iii) single cell을 각각 tube에 담아서 원심분리(1000rpm 5분) 시킨후 상층액을 제거한후 thymus는 5ml의 PBS를, lymphnode는 1ml의 PBS를 각각 넣고 섞어준 후에 FACS 전용튜브에 옮겨준다.
iv) 두 개의 튜브 모두 α-CD4 Ab-FITC와 α-CD8 Ab-PE를 넣어준다.
→FACS기계에서 레이져를 쐈을때 FL1이 FITC와 반응하여 녹색을 나타내고,
FL2는 PE와 반응하여 붉은색을 나타내서 이것을 가지고 결과를 낸다.
v)위의 두 튜브에 담긴 thymus와 lymphnode를 FACS기계에 넣고 작동시킨다.
→FACS의 작동원리는 세포를 하나씩 흘려 보내면서 레이져(FL1,FL2,FSC,SSC)를
쏴서 세포의 크기, 과립밀도, FITS와PE의 밀도등을 알아낸다. 결과ㅑ에 나온 점
하나하나는 각각 세포 한 개다.
추천자료
 실험5. 흡광광도 분석
실험5. 흡광광도 분석 [자연과학] 무게법 분석
[자연과학] 무게법 분석 [일반화학실험]흡수분석광과Beer의법칙(예비,결과모두포함)
[일반화학실험]흡수분석광과Beer의법칙(예비,결과모두포함) 나노재료 구조 분석
나노재료 구조 분석 GC HPLC 기기분석 실험레포트
GC HPLC 기기분석 실험레포트 부피재는용기 검정 및 분석화학 용어
부피재는용기 검정 및 분석화학 용어 흡광도에 의한 분석법
흡광도에 의한 분석법 염화물의 침전법 부피분석 : Fajans 법 Determination of chloride : the Fajans method
염화물의 침전법 부피분석 : Fajans 법 Determination of chloride : the Fajans method 카페인(Caffeine) 분석보고서 - 청량음료 중 카페인의 함량을 분광광도계로 구하는 실험
카페인(Caffeine) 분석보고서 - 청량음료 중 카페인의 함량을 분광광도계로 구하는 실험 (분석화학) 비타민 c의 요오드 적정-레포트
(분석화학) 비타민 c의 요오드 적정-레포트 [환경분석 및 실험] 총부유질량의 측정
[환경분석 및 실험] 총부유질량의 측정 1. 양이온 1족과 6족의 정성분석(예비)
1. 양이온 1족과 6족의 정성분석(예비)


























소개글