목차
1. 실험 목적
2. 이론
( 1 ) 적정
( 2 ) 전위차 적정법
( 3 ) 유리 전극과 칼로멜 전극
( 4 ) 센 염기에 의한 약산의 적정
( 5 ) 완충 용액
3. 기구 및 시약
4. 실험 절차
5. 시약 조사
6. 참고 자료
1. 실험 절차
2. 실험값 측정
3. 실험값 계산
4. 결과
5. 토의
2. 이론
( 1 ) 적정
( 2 ) 전위차 적정법
( 3 ) 유리 전극과 칼로멜 전극
( 4 ) 센 염기에 의한 약산의 적정
( 5 ) 완충 용액
3. 기구 및 시약
4. 실험 절차
5. 시약 조사
6. 참고 자료
1. 실험 절차
2. 실험값 측정
3. 실험값 계산
4. 결과
5. 토의
본문내용
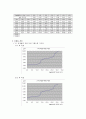
9.0
20.0
21.0
22.0
23.0
24.0
25.0
26.0
26.2
26.4
6.73
6.86
7.01
7.16
7.31
7.49
7.73
8.16
8.31
8.52
26.6
26.8
27.0
27.2
27.4
27.6
27.8
28.0
29.0
30.0
8.79
9.23
9.83
10.07
10.35
10.42
10.49
10.60
10.89
11.07
31.0
11.20
3. 실험값 계산
( 1 ) 측정값의 적정 곡선 그래프를 그린다.
1) 1 차 측정
2) 2 차 측정
( 2 ) 그래프에서 당량점을 추정한다.
곡선이 가장 급경사를 이루는 구간의 가운데 값을 당량점으로 정하고 그 때의 를 계산한다. ( pH = - log , = )
1) 1 차 측정
◆ 제 1 당량점 ( 염기 ml , pH ) ⇒ ( 13.6 , 5.03 )
=
◆ 제 2 당량점 ( 염기 ml , pH ) ⇒ ( 27.2 , 9.53 )
=
2) 2 차 측정
◆ 제 1 당량점 ( 염기 ml , pH ) ⇒ ( 13.2 , 4.52 )
=
◆ 제 2 당량점 ( 염기 ml , pH ) ⇒ ( 26.8 , 9.23 )
=
( 3 ) 인산의 값을 구한다.
인산의 1 차 반응식은 다음과 같다.
이 식은 의 형태로 나타낼 수 있다. 적정 실험에서 사용되는 염기의 화학식을 로 두면 전체 반응식은 의 형태가 된다. 의 값을 구하기 위해 근사식 을 사용하며 여기서 는,는 를 나타낸다.
1) pH 값에서 를, 넣어준 염기의 부피로 와 를 계산한다.
◆ pH = - log 이므로 = 로 두어 계산할 수 있다.
◆ 인산 용액 속의 인산의 몰수는 mol 이다. 염기 ml 를 넣어주었다고 가정했을 경우 사용된 염기의 전체 몰수는 mol 이며, 따라서 넣어준 염기가 모두 인산과 반응한다고 가정 한다면 사용된 염기의 부피에서 남은 인산 의 몰수와 농도를 계산할 수 있다.
ml 의 염기가 투여되었을 때, 의 농도는 다음과 같다.
mol / L
◆ 전체 반응식에서 대 의 몰수비는 1 : 1 이다. 염기 ml 를 넣었을 때 염기의 몰수는 mol 이고, 따라서 생성되는 도 mol 이 된다. 는,
mol / L
로 계산할 수 있다.
2) 그래프에서 제 1 당량점의 염기 부피의 절반이 되는 점을 찾는다.
◆ 1 차 측정 ( 염기 ml , pH ) ⇒ ( 6.8≒7.0 , 2.52 )
◆ 2 차 측정 ( 염기 ml , pH ) ⇒ ( 6.6≒7.0 , 2.52 )
3) 위에서 구한 점의 측정값으로 와 , 를 계산한다.
◆ 1 차 & 2 차 측정 ( 구한 점이 같으므로 결과도 같다. )
=
4) 공식을 이용하여, 최종적으로 의 값을 구한다. ( 1 차 & 2 차 공통 )
( 음수가 나왔다.... )
( 4 ) 인산의 값을 구한다.
인산의 2 차 반응식은 다음과 같다.
이 식도 역시 의 형태로 나타낼 수 있고, 전체 반응식 또한 로 둘 수 있다. 반응식의 형태와 실험 조건이 동일 하므로 의 값을 구할 때 사용한 공식들로 와 , 를 구할 수 있다. 단, 의 값은 의 공식을 사용하여 계산한다.
1) 제 1 당량점과 제 2 당량점의 중간 지점을 잡는다.
이 점에서의 데이터를 바탕으로 를 계산한다.
◆ 1 차 측정 ( 염기 ml , pH ) ⇒ ( 20.4≒20 , 6.85 )
◆ 2 차 측정 ( 염기 ml , pH ) ⇒ ( 20 , 6.86 )
2) 와 , 의 값을 구한다.
◆ 1 차 측정
◆ 2 차 측정
와 는 1 차 측정에서 나온 값과 동일하다.
3) 공식을 사용하여 의 값을 구한다.
◆ 1 차 측정
◆ 2 차 측정
4. 결과
인산의 이온화 반응과 각 반응의 이온화 상수들은 다음과 같다.
아쉽게도 모든 과 의 값이 음수가 나왔다. 엄청난 오차로 인해 1 차 측정과 2 차 측정에서의 이온화 상수값 비교나 문헌치와의 비교는 무의미해져 버리고 말았고, 음수의 값이기 때문에 도 구할 수 없었다. 오차의 원인을 뒤의 토의에서 나름대로 예측해 보았다.
5. 토의
최악의 실험값이 나와버려서 오랜 시간에 걸친 실험이 모두 헛수고가 되고 말았다. 1 차 측정과 2 차 측정에서 적정 곡선의 형태가 비교적 뚜렷하게 나왔고, pH 가 급격히 상승하는 변곡 구간에서의 당량점 선택은 비교적 정확했으리라 생각된다. 이 실험에서의 2 가지 데이터 ― pH , 용액에 넣은 염기의 ml 부피 ― 측정에서 대부분의 오차가 기인했을 것이고, 그 외에 실험에 사용된 0.1 염기 용액과 0.05 용액의 농도 조성에서도 오차가 생겼을 가능성이 있다. 그 외에 실험에 사용된 공식들은 산 - 염기의 고유한 반응식을 토대로 계산해낸 것이므로 가정대로 반응만 제대로 일어났다면 공식 자체의 오차의 여지는 없을 것이다. 하지만 오차가 섞인 데이터를 대입하여 공식을 사용 하였으므로 이 과정에서 오차가 더욱 증폭되었으리라 여겨진다.
pH 의 측정은 pH 미터를 사용하였는데, 일정량의 염기를 넣고 난 후 측정되는 pH 의 값이 일정 범위에서 계속 변동하여 실험에 필요한 특정한 값을 정하기가 어려웠다. 교반기로 용액을 계속 교반시켜 주어서인지 아니면 pH 미터의 전극이 그만큼 예민해서 그런지는 알 수 없지만 이러한 현상이 오차에 직접적으로 영향을 미쳤을 가능성이 크다. pH 의 값이 약간만 변해도 = 의 계산값의 변화는 치명적일 수 있기 때문이다. 그리고 pH 미터의 보정도 제대로 이루어졌다고 자신하기는 어렵다. 측정 후 pH 미터의 전극을 증류수에 담가두는 것만으로는 정확한 보정이라고 하기 어려울 것이다.
용액에 투여되는 염기의 부피도 뷰렛의 눈금을 육안으로 보고 측정한 것이기 때문에 충분히 오차가 생길 여지가 있다. 정해진 부피 이상의 염기를 넣는 실수도 몇 번 있었고, 어쩌면 투여된 염기가 충분히 교반되지 않은 상태에서 pH를 읽었을 수도 있다. 용액에 넣어지는 염기의 양에 따라 pH 가 변화하므로 두 가지 데이터의 오차가 복합적으로 작용하여 오차를 크게 했을 것이다.
네 가지 이온화 상수의 값이 모두 음수가 나온 이유를 계속 추정해 보았지만 확실한 것은 알아내지 못하였다. 추측이지만 투여된 염기의 부피에 비해 pH 값이 높게 , 또는 낮게 나왔기
20.0
21.0
22.0
23.0
24.0
25.0
26.0
26.2
26.4
6.73
6.86
7.01
7.16
7.31
7.49
7.73
8.16
8.31
8.52
26.6
26.8
27.0
27.2
27.4
27.6
27.8
28.0
29.0
30.0
8.79
9.23
9.83
10.07
10.35
10.42
10.49
10.60
10.89
11.07
31.0
11.20
3. 실험값 계산
( 1 ) 측정값의 적정 곡선 그래프를 그린다.
1) 1 차 측정
2) 2 차 측정
( 2 ) 그래프에서 당량점을 추정한다.
곡선이 가장 급경사를 이루는 구간의 가운데 값을 당량점으로 정하고 그 때의 를 계산한다. ( pH = - log , = )
1) 1 차 측정
◆ 제 1 당량점 ( 염기 ml , pH ) ⇒ ( 13.6 , 5.03 )
=
◆ 제 2 당량점 ( 염기 ml , pH ) ⇒ ( 27.2 , 9.53 )
=
2) 2 차 측정
◆ 제 1 당량점 ( 염기 ml , pH ) ⇒ ( 13.2 , 4.52 )
=
◆ 제 2 당량점 ( 염기 ml , pH ) ⇒ ( 26.8 , 9.23 )
=
( 3 ) 인산의 값을 구한다.
인산의 1 차 반응식은 다음과 같다.
이 식은 의 형태로 나타낼 수 있다. 적정 실험에서 사용되는 염기의 화학식을 로 두면 전체 반응식은 의 형태가 된다. 의 값을 구하기 위해 근사식 을 사용하며 여기서 는,는 를 나타낸다.
1) pH 값에서 를, 넣어준 염기의 부피로 와 를 계산한다.
◆ pH = - log 이므로 = 로 두어 계산할 수 있다.
◆ 인산 용액 속의 인산의 몰수는 mol 이다. 염기 ml 를 넣어주었다고 가정했을 경우 사용된 염기의 전체 몰수는 mol 이며, 따라서 넣어준 염기가 모두 인산과 반응한다고 가정 한다면 사용된 염기의 부피에서 남은 인산 의 몰수와 농도를 계산할 수 있다.
ml 의 염기가 투여되었을 때, 의 농도는 다음과 같다.
mol / L
◆ 전체 반응식에서 대 의 몰수비는 1 : 1 이다. 염기 ml 를 넣었을 때 염기의 몰수는 mol 이고, 따라서 생성되는 도 mol 이 된다. 는,
mol / L
로 계산할 수 있다.
2) 그래프에서 제 1 당량점의 염기 부피의 절반이 되는 점을 찾는다.
◆ 1 차 측정 ( 염기 ml , pH ) ⇒ ( 6.8≒7.0 , 2.52 )
◆ 2 차 측정 ( 염기 ml , pH ) ⇒ ( 6.6≒7.0 , 2.52 )
3) 위에서 구한 점의 측정값으로 와 , 를 계산한다.
◆ 1 차 & 2 차 측정 ( 구한 점이 같으므로 결과도 같다. )
=
4) 공식을 이용하여, 최종적으로 의 값을 구한다. ( 1 차 & 2 차 공통 )
( 음수가 나왔다.... )
( 4 ) 인산의 값을 구한다.
인산의 2 차 반응식은 다음과 같다.
이 식도 역시 의 형태로 나타낼 수 있고, 전체 반응식 또한 로 둘 수 있다. 반응식의 형태와 실험 조건이 동일 하므로 의 값을 구할 때 사용한 공식들로 와 , 를 구할 수 있다. 단, 의 값은 의 공식을 사용하여 계산한다.
1) 제 1 당량점과 제 2 당량점의 중간 지점을 잡는다.
이 점에서의 데이터를 바탕으로 를 계산한다.
◆ 1 차 측정 ( 염기 ml , pH ) ⇒ ( 20.4≒20 , 6.85 )
◆ 2 차 측정 ( 염기 ml , pH ) ⇒ ( 20 , 6.86 )
2) 와 , 의 값을 구한다.
◆ 1 차 측정
◆ 2 차 측정
와 는 1 차 측정에서 나온 값과 동일하다.
3) 공식을 사용하여 의 값을 구한다.
◆ 1 차 측정
◆ 2 차 측정
4. 결과
인산의 이온화 반응과 각 반응의 이온화 상수들은 다음과 같다.
아쉽게도 모든 과 의 값이 음수가 나왔다. 엄청난 오차로 인해 1 차 측정과 2 차 측정에서의 이온화 상수값 비교나 문헌치와의 비교는 무의미해져 버리고 말았고, 음수의 값이기 때문에 도 구할 수 없었다. 오차의 원인을 뒤의 토의에서 나름대로 예측해 보았다.
5. 토의
최악의 실험값이 나와버려서 오랜 시간에 걸친 실험이 모두 헛수고가 되고 말았다. 1 차 측정과 2 차 측정에서 적정 곡선의 형태가 비교적 뚜렷하게 나왔고, pH 가 급격히 상승하는 변곡 구간에서의 당량점 선택은 비교적 정확했으리라 생각된다. 이 실험에서의 2 가지 데이터 ― pH , 용액에 넣은 염기의 ml 부피 ― 측정에서 대부분의 오차가 기인했을 것이고, 그 외에 실험에 사용된 0.1 염기 용액과 0.05 용액의 농도 조성에서도 오차가 생겼을 가능성이 있다. 그 외에 실험에 사용된 공식들은 산 - 염기의 고유한 반응식을 토대로 계산해낸 것이므로 가정대로 반응만 제대로 일어났다면 공식 자체의 오차의 여지는 없을 것이다. 하지만 오차가 섞인 데이터를 대입하여 공식을 사용 하였으므로 이 과정에서 오차가 더욱 증폭되었으리라 여겨진다.
pH 의 측정은 pH 미터를 사용하였는데, 일정량의 염기를 넣고 난 후 측정되는 pH 의 값이 일정 범위에서 계속 변동하여 실험에 필요한 특정한 값을 정하기가 어려웠다. 교반기로 용액을 계속 교반시켜 주어서인지 아니면 pH 미터의 전극이 그만큼 예민해서 그런지는 알 수 없지만 이러한 현상이 오차에 직접적으로 영향을 미쳤을 가능성이 크다. pH 의 값이 약간만 변해도 = 의 계산값의 변화는 치명적일 수 있기 때문이다. 그리고 pH 미터의 보정도 제대로 이루어졌다고 자신하기는 어렵다. 측정 후 pH 미터의 전극을 증류수에 담가두는 것만으로는 정확한 보정이라고 하기 어려울 것이다.
용액에 투여되는 염기의 부피도 뷰렛의 눈금을 육안으로 보고 측정한 것이기 때문에 충분히 오차가 생길 여지가 있다. 정해진 부피 이상의 염기를 넣는 실수도 몇 번 있었고, 어쩌면 투여된 염기가 충분히 교반되지 않은 상태에서 pH를 읽었을 수도 있다. 용액에 넣어지는 염기의 양에 따라 pH 가 변화하므로 두 가지 데이터의 오차가 복합적으로 작용하여 오차를 크게 했을 것이다.
네 가지 이온화 상수의 값이 모두 음수가 나온 이유를 계속 추정해 보았지만 확실한 것은 알아내지 못하였다. 추측이지만 투여된 염기의 부피에 비해 pH 값이 높게 , 또는 낮게 나왔기
추천자료
 직류전기로 Metal Billet용 Sleeve 내화벽돌의 손상거동
직류전기로 Metal Billet용 Sleeve 내화벽돌의 손상거동 기체방전효과 예비보고서
기체방전효과 예비보고서 저온 동시소성 세라믹(Low Temperature Co-fired Ceramic LTCC)
저온 동시소성 세라믹(Low Temperature Co-fired Ceramic LTCC) 염화수소(티오시안산제이수은법)
염화수소(티오시안산제이수은법) 발광다이오드 LED (Light Emitting Diode)
발광다이오드 LED (Light Emitting Diode) 흡광광도법 (인도페놀법) 예비 결과 실험 레포트
흡광광도법 (인도페놀법) 예비 결과 실험 레포트 LTCC , 기판 , 유전체
LTCC , 기판 , 유전체 [현대물리실험] 프랑크 - 헤르쯔 실험
[현대물리실험] 프랑크 - 헤르쯔 실험 망막검사 Retinal Examination
망막검사 Retinal Examination  신소재 공학 - 태양전지의 원리 및 이용
신소재 공학 - 태양전지의 원리 및 이용 [화학적 산소요구량]COD(화학적 산소요구량)측정과 COD(화학적 산소요구량)시험, GOD(글루코...
[화학적 산소요구량]COD(화학적 산소요구량)측정과 COD(화학적 산소요구량)시험, GOD(글루코... PDP의 구조
PDP의 구조 PDP의 특징과 장단점
PDP의 특징과 장단점 인공 심박동기 (1. 인공 심박동기2. 인공 심박동기의 유형3. 인공 심박동기 이식 전,후 간호 ...
인공 심박동기 (1. 인공 심박동기2. 인공 심박동기의 유형3. 인공 심박동기 이식 전,후 간호 ...































소개글