목차
1.실험 목적
2.Apparatus & Reagents
3.실험 방법
(1) 에테르 정제
(2) 아세트산 적정
4. Result
5. Discussion
-추출 공정-
-분배 곡선(distribution curve)-
-속슬렛 추출기-
-추출증류-
6. Referenc
2.Apparatus & Reagents
3.실험 방법
(1) 에테르 정제
(2) 아세트산 적정
4. Result
5. Discussion
-추출 공정-
-분배 곡선(distribution curve)-
-속슬렛 추출기-
-추출증류-
6. Referenc
본문내용
적(drop)의 크기를 작게 하던가 접촉을 용이하게 하는 충진탑이 이용된다. 이러한 접촉 과정은 추출상 내의 추질의 양과 추잔상에서 추질의 양이 상평형에 이를 때까지 충분한 시간 동안 이루어지는 것이 바람직하다.
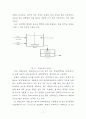
초산 수용액에 함유된 초산을 벤젠에 의해 추출하는 추출 공정의 개념도(그림 3-1)를 그리면 다음과 같다.
위의 개념도에서 추출상(extract)에 섞여 있는 추제(벤젠)와 추질(초산)은 보통 증류에 의해 분리된 후 추제(벤젠)는 회수하여 재 사용된다.
추출이 용해도의 차이를 이용한 분리 공정이라고 해서 추제가 추질을 용해하는 능력(용해도)이 추료중에 있던 원용매(원료중의 용매)가 추질을 용해하는 능력에 비해 반드시 커야 하는 것은 아니다. 예를 들어, 초산-물의 2성분계에서 초산을 벤젠으로 추출하는 경우, 벤젠에 의한 초산의 용해도는 오히려 물에 의한 초산의 용해도 보다 낮다. 그럼에도 불구하고 벤젠을 사용하여 초산을 추출할 수 있는 것은 벤젠의 초산에 대한 선택도(selectivity) 때문이다. 즉, 벤젠은 물에 비하여 초산을 훨씬 선택적으로 용해시키기 때문에 초산과 물을 분리하는 능력을 갖고 있다.
위 개념도에서 추료(초산+물)에 추제(벤젠)가 가해졌을 때 초산-물-벤젠의 3성분계(tertiary system)가 형성된다. 추출이 이루어지기 위해서는 이 3성분계가 추출상과 추잔상으로 상분리가 이루어져야 하지만 모든 조성에서 상분리가 이루어지는 것은 아니다. 추질(초산), 원용매(물), 및 추제(벤젠)의 3성분의 혼합 비율에 따라 세 성분 전부가 용해되어 균일한 단일 액상(single phase)을 나타내는 경우와 추출상과 추잔상의 두 개의 상으로 분리 되는 경우가 있다(3-4. 용해도 곡선 참조).
-분배 곡선(distribution curve)-
추잔상에서의 추질의 농도(중량분율)를 x, 추출상에서의 추질의 농도(중량분율)를 y라 하여, x-y 곡선을 그리면, 초산-벤젠-물 계의 경우 그림 3-4와 같다. 이 곡선을 분배곡선(distribution curve)이라하며 대응선의 자료로 이용된다. 이 분배 곡선은 추질의 농도가 낮은 부분에서 근사적으로 직선 관계가 성립하는데 이것을 분배 법칙이라 하며 다음과 같이 나타낸다.
(3-4)
x : 추잔상에서 추질의 농도
y : 추출상에서 추질의 농도
여기서, K를 분배 계수(distribution coefficient)라 하며 추제의 능력을 판별하는 요소이다. 이 분배 법칙은 기체를 액체에 흡수하는 공정에서의 헨리의 법칙과 유사하다. 차이점은 추출에서 분배 법칙은 두 액체사이에서의 용질의 분배를 나타내는 반면 기체의 흡수에서 헨리의 법칙(Henry\'s law)은 기체와 액체 사이의 용질의 분배라는 점이다.
-속슬렛 추출기-
용매 플라스크 위에 추출관, 그 위에 환류냉각기가 연결된 장치이다. 추출관 속의 원통형 여과지 또는 여과관에 시료를 넣고 플라스크 속에 있는 용매를 가열하면, 용매의 증기는 화살표처럼 왼쪽 관을 지나 환류냉각기에서 응축되어 추출관에 괴어 시료 속의 가용 성분을 녹이고, 괸 액체는 오른쪽 사이펀에 의하여 그 꼭지점에 이르면 전부 용매 플라스크로 돌아오고, 새로운 용매는 또 추출관에 괸다.
이렇게 새로운 용매로 추출이 반복되고, 추출물은 용매 플라스크 속에 괸다. 추출이 끝나면 플라스크를 떼어 속에 있는 액체를 증류하면 비휘발성 성분은 증류 플라스크 속에 남는다.
-추출증류-
끓는점이 비슷한 성분이 혼합되어 있는 경우, 보통의 증류법으로는 분리할 수 없다. 이 때 추출법을 병용하면 쉽게 분리할 수 있다. 혼합된 두 성분보다 끓는점이 높은 제3성분을 가하면 두 성분 중 제3성분에 친화성이 강한 성분의 휘발도가 내려가고 두 성분간의 비휘발도가 커진다. 그 결과 분리조작이 쉬워지고 증류로 두 성분을 나눌 수 있다. 공비혼합물을 만드는 경우라도 제3성분의 첨가로 공비혼합물의 성질이 없어져 분리가 가능하게 된다. 끓는점이 비슷한 탄화수소혼합물에 끓는점이 높은 제3성분 용제를 가하여 증류하면 탄화수소 성분을 분리시킬 수 있다. 또 용제는 회수할 수도 있다. 예를 들면, 끓는점이 비슷한 벤젠(끓는점 80.1)과 시클로헥산(끓는점 80.8)의 혼합물은 공비혼합물도 되지만 여기에 메틸이소부틸케톤(끓는점 115.8)을 가하여 증류하면 쉽게 분리된다.
8. Referenc
* 一般化學 / James E. Brady / 探求當 / P. 80-81
* 화학대사전 / 김창충 외 5명 / 世和 / P. 658
초산 수용액에 함유된 초산을 벤젠에 의해 추출하는 추출 공정의 개념도(그림 3-1)를 그리면 다음과 같다.
위의 개념도에서 추출상(extract)에 섞여 있는 추제(벤젠)와 추질(초산)은 보통 증류에 의해 분리된 후 추제(벤젠)는 회수하여 재 사용된다.
추출이 용해도의 차이를 이용한 분리 공정이라고 해서 추제가 추질을 용해하는 능력(용해도)이 추료중에 있던 원용매(원료중의 용매)가 추질을 용해하는 능력에 비해 반드시 커야 하는 것은 아니다. 예를 들어, 초산-물의 2성분계에서 초산을 벤젠으로 추출하는 경우, 벤젠에 의한 초산의 용해도는 오히려 물에 의한 초산의 용해도 보다 낮다. 그럼에도 불구하고 벤젠을 사용하여 초산을 추출할 수 있는 것은 벤젠의 초산에 대한 선택도(selectivity) 때문이다. 즉, 벤젠은 물에 비하여 초산을 훨씬 선택적으로 용해시키기 때문에 초산과 물을 분리하는 능력을 갖고 있다.
위 개념도에서 추료(초산+물)에 추제(벤젠)가 가해졌을 때 초산-물-벤젠의 3성분계(tertiary system)가 형성된다. 추출이 이루어지기 위해서는 이 3성분계가 추출상과 추잔상으로 상분리가 이루어져야 하지만 모든 조성에서 상분리가 이루어지는 것은 아니다. 추질(초산), 원용매(물), 및 추제(벤젠)의 3성분의 혼합 비율에 따라 세 성분 전부가 용해되어 균일한 단일 액상(single phase)을 나타내는 경우와 추출상과 추잔상의 두 개의 상으로 분리 되는 경우가 있다(3-4. 용해도 곡선 참조).
-분배 곡선(distribution curve)-
추잔상에서의 추질의 농도(중량분율)를 x, 추출상에서의 추질의 농도(중량분율)를 y라 하여, x-y 곡선을 그리면, 초산-벤젠-물 계의 경우 그림 3-4와 같다. 이 곡선을 분배곡선(distribution curve)이라하며 대응선의 자료로 이용된다. 이 분배 곡선은 추질의 농도가 낮은 부분에서 근사적으로 직선 관계가 성립하는데 이것을 분배 법칙이라 하며 다음과 같이 나타낸다.
(3-4)
x : 추잔상에서 추질의 농도
y : 추출상에서 추질의 농도
여기서, K를 분배 계수(distribution coefficient)라 하며 추제의 능력을 판별하는 요소이다. 이 분배 법칙은 기체를 액체에 흡수하는 공정에서의 헨리의 법칙과 유사하다. 차이점은 추출에서 분배 법칙은 두 액체사이에서의 용질의 분배를 나타내는 반면 기체의 흡수에서 헨리의 법칙(Henry\'s law)은 기체와 액체 사이의 용질의 분배라는 점이다.
-속슬렛 추출기-
용매 플라스크 위에 추출관, 그 위에 환류냉각기가 연결된 장치이다. 추출관 속의 원통형 여과지 또는 여과관에 시료를 넣고 플라스크 속에 있는 용매를 가열하면, 용매의 증기는 화살표처럼 왼쪽 관을 지나 환류냉각기에서 응축되어 추출관에 괴어 시료 속의 가용 성분을 녹이고, 괸 액체는 오른쪽 사이펀에 의하여 그 꼭지점에 이르면 전부 용매 플라스크로 돌아오고, 새로운 용매는 또 추출관에 괸다.
이렇게 새로운 용매로 추출이 반복되고, 추출물은 용매 플라스크 속에 괸다. 추출이 끝나면 플라스크를 떼어 속에 있는 액체를 증류하면 비휘발성 성분은 증류 플라스크 속에 남는다.
-추출증류-
끓는점이 비슷한 성분이 혼합되어 있는 경우, 보통의 증류법으로는 분리할 수 없다. 이 때 추출법을 병용하면 쉽게 분리할 수 있다. 혼합된 두 성분보다 끓는점이 높은 제3성분을 가하면 두 성분 중 제3성분에 친화성이 강한 성분의 휘발도가 내려가고 두 성분간의 비휘발도가 커진다. 그 결과 분리조작이 쉬워지고 증류로 두 성분을 나눌 수 있다. 공비혼합물을 만드는 경우라도 제3성분의 첨가로 공비혼합물의 성질이 없어져 분리가 가능하게 된다. 끓는점이 비슷한 탄화수소혼합물에 끓는점이 높은 제3성분 용제를 가하여 증류하면 탄화수소 성분을 분리시킬 수 있다. 또 용제는 회수할 수도 있다. 예를 들면, 끓는점이 비슷한 벤젠(끓는점 80.1)과 시클로헥산(끓는점 80.8)의 혼합물은 공비혼합물도 되지만 여기에 메틸이소부틸케톤(끓는점 115.8)을 가하여 증류하면 쉽게 분리된다.
8. Referenc
* 一般化學 / James E. Brady / 探求當 / P. 80-81
* 화학대사전 / 김창충 외 5명 / 世和 / P. 658
추천자료
 [화학공학기초실험] 2. 추출
[화학공학기초실험] 2. 추출 (영양화학)녹차씨유와 양파추출물이 콜레스테롤에 미치는 영향
(영양화학)녹차씨유와 양파추출물이 콜레스테롤에 미치는 영향 [화학실험] 천연 색소의 추출
[화학실험] 천연 색소의 추출 천연물의 추출,분리,정제 및 화학구조의 분석 방법
천연물의 추출,분리,정제 및 화학구조의 분석 방법 카페인의 추출과 분리 실험보고서 (대학화학 실험)
카페인의 추출과 분리 실험보고서 (대학화학 실험) [물리화학 실험] 고체에서 성분 추출하기
[물리화학 실험] 고체에서 성분 추출하기 [일반화학 및 실험] 카페인의 추출과 분리
[일반화학 및 실험] 카페인의 추출과 분리 화학실험보고서 - 천연 색소의 추출
화학실험보고서 - 천연 색소의 추출 [유기 화학] Aldol condensation(알돌축합) : 디벤잘아세톤을 벤즈알데히드와 아세톤을 이용...
[유기 화학] Aldol condensation(알돌축합) : 디벤잘아세톤을 벤즈알데히드와 아세톤을 이용... 일반화학실험 - Isolation of caffeine from tea (차로부터 카페인의 추출 및 분리)
일반화학실험 - Isolation of caffeine from tea (차로부터 카페인의 추출 및 분리) [일반화학실험] 유기 EL(OLED) 분석
[일반화학실험] 유기 EL(OLED) 분석 [일반화학실험] 아스피린 합성 : 유기산과 알코올이 반응하여 에스터가 도는 과정을 통해 실...
[일반화학실험] 아스피린 합성 : 유기산과 알코올이 반응하여 에스터가 도는 과정을 통해 실... 식품화학실험A+) 식품 중의 유기산 정량
식품화학실험A+) 식품 중의 유기산 정량





























소개글