목차
1. 요약
2. Abstract
3. 서론
4. 이론
2-1. 상평형
1) 평형의 성질
2) 상평형 그림
2-2 기액평형(2성분계기액평형)
1)기액평형의 이론
2) 기액평형 계산식
5. 실험장치 및 방법
5-1 실험장치
5-2 실험방법
5-3 주의할 점
6. 실험결과 및 분석
7. 결론
8. 사용기호
9. 인용문헌
10. 부록
10-1 단 공정의 원리
10-2 단증류 (simple distillation)
10-3 증기압곡선과 휘발도
2. Abstract
3. 서론
4. 이론
2-1. 상평형
1) 평형의 성질
2) 상평형 그림
2-2 기액평형(2성분계기액평형)
1)기액평형의 이론
2) 기액평형 계산식
5. 실험장치 및 방법
5-1 실험장치
5-2 실험방법
5-3 주의할 점
6. 실험결과 및 분석
7. 결론
8. 사용기호
9. 인용문헌
10. 부록
10-1 단 공정의 원리
10-2 단증류 (simple distillation)
10-3 증기압곡선과 휘발도
본문내용
크다는 것을 보여준다.
기체의 한 성분을 비휘발성 용매에 흡수시키는 경우 두 상이 탑을 통과함에 따라 기체의 총유량은 감소하는 반면, 액체의 총 유량은 증가한다. L과 V는 둘 다 탑 밑부분에서 제일 크고 꼭대기에서 가장 작기 때문에 조작선의 기울기, 즉 L/V의 변화율은 L 또는 V 의 변화 그 자체만큼 크지는 않지만 조작선은 보통 곡선이 된다.
이상단 수의 결정에 있어서 전반적인 중요 문제는 실제 증류탑에서 원하는 농도범위, 즉 xa에서 xb 또는 ya에서 yb를 달성하는데 필요한 이상단의 수(Ideal Stage)를 구하는 것이다. 이 수를 알 수 있고, 또한, 단 효율을 안다면 실제단의 수를 계산할 수 있다. 이것이 증류탑을 설계하는 통상적인 방법이다.
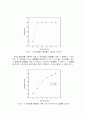
각 상에 두 성분만 있을 때 이상단 수를 결정하는 간단한 방법은 조작선을 이용하는 도해적 작도법이다. 아래의 그림은 증류탑에 대한 조작선(Operating Line)과 평형곡선(Equilibrium Line)이다. 탑의 상부에서는 위로부터 아래로 액체상의 흐름이 있고 탑의 하부에서는 반대로 아래로부터 위로의 기체상의 흐름이 있다.
이때, (n-1)단으로부터 내려오는 액체상은 (n+1)단으로부터 상승하는 증기와 접촉하여 가열되며 저비점성분의 일부가 증발하게 된다. 이와 동시에 상승하는 증기상은 액체상과 접촉해서 냉각되며 고비점성분의 일부는 액화된다. 액체상의 저비점 성분은 a점에서 m점까지 진행하게 되고, 결국 몰분율이 xn-1에서 xn으로 감소하며 증기상의 성분은 n점에서 m점까지 진행하여 몰분율이 yn+1에서 yn으로 증가된다. 이것을 조작선에서 보면 n단에서 액체상의 저비점 성분은 a에서 m으로 이동한 것이고, 증기상의 경우는 n에서 a로 이동했다고 볼 수 있다. 그리고 이러한 두 상간의 작용이 각 단마다 이루어진다고 볼 수 있다. 점 a, m및 n으로 이루어진 계단 또는 삼각형은 한 개의 이상단을 표시하며, 이 탑에서는 첫 번째 단이다. 두 번째 단은 같은 작도를 반복함으로써 선도상에 도식적으로 구할 수 있다. 즉, 수평으로 점 o 위치의 평형곡선까지 가서, 다시 수직적으로 조작선 상의 점 b까지 가면 된다.
기체흡수, 증류, 침출 또는 액체추출 중 어느 다단식 반응기에서나 이상단수를 구하는데는 같은 방법을 이용할 수 있다. 이상단 수를 알기 위해 조작선과 평형선을 교대로 이용하면서 도식적으로 계단 하나하나를 그려나가는 법은 증류탑 설계에 처음 이용되었고, 이 방법을 McCabe-Thiele법 이라한다.
그 작도는 탑 양끝의 어느 한 쪽에서 시작하며, 일반적으로 마지막 계단이 그림에서처럼 꼭 마지막 단의 농도와 맞아떨어질 필요는 없다. 한 개 미만의 단은 그대로 남겨 둘 수도 있고 반올림 할 수도 있다.
10-2 단증류 (simple distillation)
회분증류 중 가장 간단한 예가 단증류이다. 일정량의 액체 혼합물을 가열하여 생긴 증기를 냉각기로 보내어 응축시켜 저비점 성분이 풍부한 액체를 얻는 방법으로 미분증류(differential distillation) 또는 회분조작을 하므로 회분단증류 (simple batch distillation)라고도 한다.
이 공정에서는 끓는 액체로부터 형성된 증기가 이 계에 의해 한 번에 제거되어 진다. 이 증기는 액체보다 더 휘발성이 높기 때문에 남아 있는 액체는 이 성분에 점점 줄어들 것이다. 이 결과 제품의 구성성분을 점진적으로 변화시킬 수 있다. 그래서 짧은 시간에 걸쳐 형성된 증기는 액체와 평형상태에 있는 반면 전압은 잔류액체와 함께 평형에 이르지 않는다. 공정의 끝에 증기가 되지 못한 액체는 탑저제품(bottom product)으로 제거 되어진다.
이 방법은 Rayleigh에 의해 처음으로 제안되었다. 증류기 안의 어느 순간의 액량을 W라 하고 성분 A의 몰분율을 x라 하면 A의 몰분율을 담고 있는 dW 가 증기가 된다고 가정하면, 이때, 성분 A의 물질수지는
우변은 y와 x 사이에 평형관계가 성립된다면 도식적으로 풀이 될 수 있다. 만약 평형 관계가 y = mx + C 형태의 직선을 이룬다면 위 식들은 다음과 같이 나타낼 수 있다.
또는,
이 식으로부터 증류기내 주어진 농도의 액체를 얻기 위해 증류된 액체의 양은 계산될 수 있고, 산출물의 평균조성은 물질수지에 의해 얻어 질 수 있다.
10-3 증기압곡선과 휘발도
Raoult의 법칙에 따르는 이상용액은 용액을 구성하는 분자들간의 인력이 비슷한 경우로써 벤젠-톨루엔 계, 메탄올-에탄올 계 등이 이에 해당한다. 이 경우 일정한 온도에서의 증기압 곡선은 아래 그림의 (a)와 같다.
그러나, 실제용액의 경우는 Raoult의 법칙으로부터 벗어나는데, 그림 (b)와 같이 이상용액에 비해 증기압이 크게 나타나는 경우를 정편차(positive deviation)라고 하며, 증기압 곡선은 극대점 Ah를 갖는다.
예를들어, 물-에탄올계, 에탄올-벤젠계 및 아세톤-CS2와 같이 동종분자간 인력이 이종분자간 인력보다 클 때 나타난다. 반면, 그림 (c)는 증기압이 이상용액에 비해 작게 나타나는 경우로써 부편차(negative deviation) 라고 하며, 극소점 Al을 갖는다. 아세톤-클로로포름계, 물-염산계, 물-질산, 물-황산계와 같이 동종분자간 인력이 이종분자간 인력보다 작을 때 이러한 현상이 일어난다.
이러한 용액을 비이상용액 (nonideal solution)이라고 하며, 이 때의 Raoult의 법칙은 활동도 계수를 사용하여 보정되어야 한다.
따라서, 액상이 비이상용액이고 기상이 이상기체인 경우(즉 P = PA+PB)의 비휘발도는 다음 식으로 표시된다.
여기서 γA, γB는 각각 용액 중의 낮은 끓는점 성분과 높은 끓는점 성분의 활동도계수 (activity coefficient) 이다. 따라서 이상용액의 경우γA=γB=1 로써 Raoult의 법칙과 같아진다. 그림 (b)는 γA>1, γB>1 로써 이상용액의 경우 보다 비정상적으로 높은 경우이며 그림 (c)는 γA<1, γB<1 로써 이상용액의 경우 보다 비정상적으로 낮은 경우이다.
기체의 한 성분을 비휘발성 용매에 흡수시키는 경우 두 상이 탑을 통과함에 따라 기체의 총유량은 감소하는 반면, 액체의 총 유량은 증가한다. L과 V는 둘 다 탑 밑부분에서 제일 크고 꼭대기에서 가장 작기 때문에 조작선의 기울기, 즉 L/V의 변화율은 L 또는 V 의 변화 그 자체만큼 크지는 않지만 조작선은 보통 곡선이 된다.
이상단 수의 결정에 있어서 전반적인 중요 문제는 실제 증류탑에서 원하는 농도범위, 즉 xa에서 xb 또는 ya에서 yb를 달성하는데 필요한 이상단의 수(Ideal Stage)를 구하는 것이다. 이 수를 알 수 있고, 또한, 단 효율을 안다면 실제단의 수를 계산할 수 있다. 이것이 증류탑을 설계하는 통상적인 방법이다.
각 상에 두 성분만 있을 때 이상단 수를 결정하는 간단한 방법은 조작선을 이용하는 도해적 작도법이다. 아래의 그림은 증류탑에 대한 조작선(Operating Line)과 평형곡선(Equilibrium Line)이다. 탑의 상부에서는 위로부터 아래로 액체상의 흐름이 있고 탑의 하부에서는 반대로 아래로부터 위로의 기체상의 흐름이 있다.
이때, (n-1)단으로부터 내려오는 액체상은 (n+1)단으로부터 상승하는 증기와 접촉하여 가열되며 저비점성분의 일부가 증발하게 된다. 이와 동시에 상승하는 증기상은 액체상과 접촉해서 냉각되며 고비점성분의 일부는 액화된다. 액체상의 저비점 성분은 a점에서 m점까지 진행하게 되고, 결국 몰분율이 xn-1에서 xn으로 감소하며 증기상의 성분은 n점에서 m점까지 진행하여 몰분율이 yn+1에서 yn으로 증가된다. 이것을 조작선에서 보면 n단에서 액체상의 저비점 성분은 a에서 m으로 이동한 것이고, 증기상의 경우는 n에서 a로 이동했다고 볼 수 있다. 그리고 이러한 두 상간의 작용이 각 단마다 이루어진다고 볼 수 있다. 점 a, m및 n으로 이루어진 계단 또는 삼각형은 한 개의 이상단을 표시하며, 이 탑에서는 첫 번째 단이다. 두 번째 단은 같은 작도를 반복함으로써 선도상에 도식적으로 구할 수 있다. 즉, 수평으로 점 o 위치의 평형곡선까지 가서, 다시 수직적으로 조작선 상의 점 b까지 가면 된다.
기체흡수, 증류, 침출 또는 액체추출 중 어느 다단식 반응기에서나 이상단수를 구하는데는 같은 방법을 이용할 수 있다. 이상단 수를 알기 위해 조작선과 평형선을 교대로 이용하면서 도식적으로 계단 하나하나를 그려나가는 법은 증류탑 설계에 처음 이용되었고, 이 방법을 McCabe-Thiele법 이라한다.
그 작도는 탑 양끝의 어느 한 쪽에서 시작하며, 일반적으로 마지막 계단이 그림에서처럼 꼭 마지막 단의 농도와 맞아떨어질 필요는 없다. 한 개 미만의 단은 그대로 남겨 둘 수도 있고 반올림 할 수도 있다.
10-2 단증류 (simple distillation)
회분증류 중 가장 간단한 예가 단증류이다. 일정량의 액체 혼합물을 가열하여 생긴 증기를 냉각기로 보내어 응축시켜 저비점 성분이 풍부한 액체를 얻는 방법으로 미분증류(differential distillation) 또는 회분조작을 하므로 회분단증류 (simple batch distillation)라고도 한다.
이 공정에서는 끓는 액체로부터 형성된 증기가 이 계에 의해 한 번에 제거되어 진다. 이 증기는 액체보다 더 휘발성이 높기 때문에 남아 있는 액체는 이 성분에 점점 줄어들 것이다. 이 결과 제품의 구성성분을 점진적으로 변화시킬 수 있다. 그래서 짧은 시간에 걸쳐 형성된 증기는 액체와 평형상태에 있는 반면 전압은 잔류액체와 함께 평형에 이르지 않는다. 공정의 끝에 증기가 되지 못한 액체는 탑저제품(bottom product)으로 제거 되어진다.
이 방법은 Rayleigh에 의해 처음으로 제안되었다. 증류기 안의 어느 순간의 액량을 W라 하고 성분 A의 몰분율을 x라 하면 A의 몰분율을 담고 있는 dW 가 증기가 된다고 가정하면, 이때, 성분 A의 물질수지는
우변은 y와 x 사이에 평형관계가 성립된다면 도식적으로 풀이 될 수 있다. 만약 평형 관계가 y = mx + C 형태의 직선을 이룬다면 위 식들은 다음과 같이 나타낼 수 있다.
또는,
이 식으로부터 증류기내 주어진 농도의 액체를 얻기 위해 증류된 액체의 양은 계산될 수 있고, 산출물의 평균조성은 물질수지에 의해 얻어 질 수 있다.
10-3 증기압곡선과 휘발도
Raoult의 법칙에 따르는 이상용액은 용액을 구성하는 분자들간의 인력이 비슷한 경우로써 벤젠-톨루엔 계, 메탄올-에탄올 계 등이 이에 해당한다. 이 경우 일정한 온도에서의 증기압 곡선은 아래 그림의 (a)와 같다.
그러나, 실제용액의 경우는 Raoult의 법칙으로부터 벗어나는데, 그림 (b)와 같이 이상용액에 비해 증기압이 크게 나타나는 경우를 정편차(positive deviation)라고 하며, 증기압 곡선은 극대점 Ah를 갖는다.
예를들어, 물-에탄올계, 에탄올-벤젠계 및 아세톤-CS2와 같이 동종분자간 인력이 이종분자간 인력보다 클 때 나타난다. 반면, 그림 (c)는 증기압이 이상용액에 비해 작게 나타나는 경우로써 부편차(negative deviation) 라고 하며, 극소점 Al을 갖는다. 아세톤-클로로포름계, 물-염산계, 물-질산, 물-황산계와 같이 동종분자간 인력이 이종분자간 인력보다 작을 때 이러한 현상이 일어난다.
이러한 용액을 비이상용액 (nonideal solution)이라고 하며, 이 때의 Raoult의 법칙은 활동도 계수를 사용하여 보정되어야 한다.
따라서, 액상이 비이상용액이고 기상이 이상기체인 경우(즉 P = PA+PB)의 비휘발도는 다음 식으로 표시된다.
여기서 γA, γB는 각각 용액 중의 낮은 끓는점 성분과 높은 끓는점 성분의 활동도계수 (activity coefficient) 이다. 따라서 이상용액의 경우γA=γB=1 로써 Raoult의 법칙과 같아진다. 그림 (b)는 γA>1, γB>1 로써 이상용액의 경우 보다 비정상적으로 높은 경우이며 그림 (c)는 γA<1, γB<1 로써 이상용액의 경우 보다 비정상적으로 낮은 경우이다.





































소개글