목차
1. Purpose
2. Introduction
3. Theory
3-1. 전기화학 측정법의 분류
3-2. 순환 전압전류법 ( Cyclic Voltammetry )
3-3. 일정전류 전위차법 (Chronoamperometry)
3-4. 바이오센서 (biosensor)
3-5. Glucose oxidase (GOD)
3-6. Enzyme Kinetics
3-7. Biochip (바이오칩)
3-8. 당 측정의 응용
4. Experiment
4-1. Cyclic voltammetry
4-2. Chromoamperometry
4-3 당 센서 제작 및 당 측정
4-4. 다채널(multichannel) 당 센서 제작 및 당 측정
5. Data & Result
6. Discussion
2. Introduction
3. Theory
3-1. 전기화학 측정법의 분류
3-2. 순환 전압전류법 ( Cyclic Voltammetry )
3-3. 일정전류 전위차법 (Chronoamperometry)
3-4. 바이오센서 (biosensor)
3-5. Glucose oxidase (GOD)
3-6. Enzyme Kinetics
3-7. Biochip (바이오칩)
3-8. 당 측정의 응용
4. Experiment
4-1. Cyclic voltammetry
4-2. Chromoamperometry
4-3 당 센서 제작 및 당 측정
4-4. 다채널(multichannel) 당 센서 제작 및 당 측정
5. Data & Result
6. Discussion
본문내용
E0\' = ( Epa + Epc ) / 2 을 통하여 Epa 와 Epc의 중앙에 위치하는 E0\'값을 구해보았다(Data값에 표시). 또 그래프를 보면 환원이 일어날 때 최대전류를 찍고나서 전류가 감소하는 것을 볼 수 있다. 그 이유는 용액의 diffusion 속도보다 환원 속도가 더 빠르기 때문이다. 가역적인 system 안에서의 peak current는 Randles-Sevcik equation을 통해 scan rate 과의 관계를 알 수 있다. 그 식은 다음과 같다.
= peak current , A
n = electron stoichiometry
A = electrode area , cm2
D = diffusion coefficient, cm2/s
v = scan rate , V/s
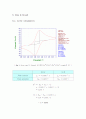
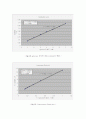
따라서 피크전류인 와 ( scan rate )1/2는 정비례한다. 그 결과를 ipc와 ipa 로 나누어 그래프를 작성한 결과가 그림 7과 8에 나와 있다. 추세선을 그어 확인해본 결과 거의 일직선에 가까운 결과를 얻을 수 있었다. peak current 가 scan rate와 바로 비례하지 않고 1/2 승에 비례하는 이유는 물질이 전극과 붙어있지 않고 용액상태로 떨어져 있기 때문이다. 이 실험의 오차원인으로는 glassy carbon 작업전극을 polishing 할 때 접촉면이 고르게 갈아지지 않은 점을 들 수 있다.
두 번째로 Chronoamperometry 실험을 하였다. Chronoamperometry란 일정한 전압을 걸어 준 후 시간에 따른 전류의 변화를 측정하는 방법으로, 용액에서의 물질의 이동에 대한 전류량을 확인 할 수 있다.
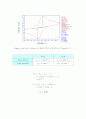
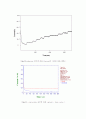
이 실험은 두 가지로 나누어 진행하였는데 첫 번째로는 1.0mM K3Fe(CN)6과 0.1M KNO3 solution 2mL를 Electro chemical cell에 넣고 환원전위를 걸어주어 바탕용액만 있을 때, convection의 유무에 따른 current와 time의 관계를 알아보았다. 그 결과는 그림 11에 나와 있다. magnetic stirrer에 의한 convection이 있는 경우에는 convection이 없을 때보다 limit current가 증가했다. 즉, 물질의 이동이 잘 되서 current가 증가한 것이다. 한계전류(limiting current)는 다음과 같은 식으로 주어진다. Il = nFAm0C0*. convection이 없는 경우, 과 전위가 걸린 전극 표면 근처의 농도변화에 대해 살펴보면, 농도는 전극에 접한 위치, 즉 x=0 인 곳에서는 0이며 먼 거리에 이르면 c0(bulk solution의농도)에 가까워짐을 알 수 있다. 또 시간 t가 길수록 거리에 따른 농도의 증가가 완만하고 실제적으로 용액 내부(x=∞)에 비하여 농도의 결핍이 있는 층(이를 확산층이라고 함)의 두께가 두꺼워짐을 알 수 있다.
다음으로 당센서를 만들어 glucose 검출실험을 하였다. 실험순서는 먼저 백금 작업 전극을 polishing 한 후 백금전극 표면에 액체 상태로 있는 GOD 1㎕를 loding 했다. GOD가 완전히 마른 후 GOD를 전극표면에 고정시키기 위해 Nafion이라는 polymer 1㎕를 loding 한다. 이렇게 준비된 작업 전극을 상대 전극(Pt counter electrode), 기준 전극(Ag/AgCl reference electrode)과 함께 potentiostat에 연결하고 0.1M, pH7.0 phosphate buffer 5mL에 담근다. 이때 용액은 magnetic stirrer를 이용하여 계속 저어준다. GOD에 의해 glucose가 산화되면서 생성되는 H2O2 를 측정하기 위해 0.6V(vs. Ag/AgCl)의 산화전압을 걸어준다. 전극표면에서는 다음과 같은 반응이 진행된다.
GODox + glucose → GODred + gluconolacton
GODred + O2 → GODox + H2O2
H2O2 → O2 + 2H+ + 2e-
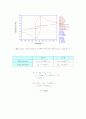
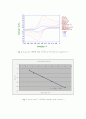
Background가 안정되면 0.25 M의 glucose를 micro-syringe를 이용해서 20μL씩 Injection 한다. (농도는 1mM식 증가한다.) 여기서 Nafion은 GOD를 전극표면에 고정시킬 뿐만 아니라 수소이온과 같은 (+)이온을 잘 통과시킨다. glucose를 1μL씩 injection 한 그래프는 그림 9와 그림 10에 나타나있다. glucose를 20μL씩 넣어줄 때마다 전류의 세기가 증가함을 볼 수 있다. 이 데이터를 가지고 glucose의 농도와 전류의 관계를 그리면 그림 12와 같이 직선 그래프가 된다. glucose를 계속 1mM 씩 넣었지만 용액의 농도가 짙어짐에 따라 GOD의 활성도가 낮아진다.
k1 k2
E+S ↔ ES → E+P
k-1
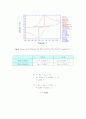
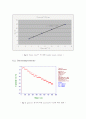
에서 효소반응 속도를 측정해 보면 속도는 기질농도[S]에 따라 달라지는 것을 알 수 있다. 처음 부분과 같이 농도가 낮은 지역에서는 속도가 기질 농도[S]에 비례함을 보여주는 1차 반응이다. 하지만 농도가 높아짐에 따라 기질 농도에 상관없이 반응하는 0차반응에 가까워진다. 따라서 후반부로 갈수록 전류의 증가폭이 줄어든다. 효소반응에 의해 생성된 기질을 전기화학 반응으로 측정한 전류는 반응 속도와 같다. 그러므로 Michaelis - Menten equation( ) 을 이용해서 Lineweaver-Burk equation ( ) 을 전개하고 1/current & 1/glucose의 농도를 plot해 보았다. 그 결과가 그림 13에 나타나있다. 가 0일때 y절편의 값은 이다. 따라서 1.1102 = 가 나왔고 역수를 취해 =0.9007㎂ 을 얻었다. 값은 임의의 한 점을 대입해서 구한다. 그 결과 = 11.40mM 이 나왔다.
이 실험을 할때 주의할 점이 glucose를 1mM씩 injection 할 때 주위의 전극들을 건드리지 않고 한번에 injection 하는 것이 중요했는데 손의 부주의로 인하여 그래프에 떨림이 측정되었다. 좋은 실험결과가 되려면 의 값이 더 높게 나와서 최대속도의 1/2로 일어나는 반응의 기질농도인 이 더 낮게 측정되었어야 했는데 그렇게 되지 못한것이 아쉬웠다.
= peak current , A
n = electron stoichiometry
A = electrode area , cm2
D = diffusion coefficient, cm2/s
v = scan rate , V/s
따라서 피크전류인 와 ( scan rate )1/2는 정비례한다. 그 결과를 ipc와 ipa 로 나누어 그래프를 작성한 결과가 그림 7과 8에 나와 있다. 추세선을 그어 확인해본 결과 거의 일직선에 가까운 결과를 얻을 수 있었다. peak current 가 scan rate와 바로 비례하지 않고 1/2 승에 비례하는 이유는 물질이 전극과 붙어있지 않고 용액상태로 떨어져 있기 때문이다. 이 실험의 오차원인으로는 glassy carbon 작업전극을 polishing 할 때 접촉면이 고르게 갈아지지 않은 점을 들 수 있다.
두 번째로 Chronoamperometry 실험을 하였다. Chronoamperometry란 일정한 전압을 걸어 준 후 시간에 따른 전류의 변화를 측정하는 방법으로, 용액에서의 물질의 이동에 대한 전류량을 확인 할 수 있다.
이 실험은 두 가지로 나누어 진행하였는데 첫 번째로는 1.0mM K3Fe(CN)6과 0.1M KNO3 solution 2mL를 Electro chemical cell에 넣고 환원전위를 걸어주어 바탕용액만 있을 때, convection의 유무에 따른 current와 time의 관계를 알아보았다. 그 결과는 그림 11에 나와 있다. magnetic stirrer에 의한 convection이 있는 경우에는 convection이 없을 때보다 limit current가 증가했다. 즉, 물질의 이동이 잘 되서 current가 증가한 것이다. 한계전류(limiting current)는 다음과 같은 식으로 주어진다. Il = nFAm0C0*. convection이 없는 경우, 과 전위가 걸린 전극 표면 근처의 농도변화에 대해 살펴보면, 농도는 전극에 접한 위치, 즉 x=0 인 곳에서는 0이며 먼 거리에 이르면 c0(bulk solution의농도)에 가까워짐을 알 수 있다. 또 시간 t가 길수록 거리에 따른 농도의 증가가 완만하고 실제적으로 용액 내부(x=∞)에 비하여 농도의 결핍이 있는 층(이를 확산층이라고 함)의 두께가 두꺼워짐을 알 수 있다.
다음으로 당센서를 만들어 glucose 검출실험을 하였다. 실험순서는 먼저 백금 작업 전극을 polishing 한 후 백금전극 표면에 액체 상태로 있는 GOD 1㎕를 loding 했다. GOD가 완전히 마른 후 GOD를 전극표면에 고정시키기 위해 Nafion이라는 polymer 1㎕를 loding 한다. 이렇게 준비된 작업 전극을 상대 전극(Pt counter electrode), 기준 전극(Ag/AgCl reference electrode)과 함께 potentiostat에 연결하고 0.1M, pH7.0 phosphate buffer 5mL에 담근다. 이때 용액은 magnetic stirrer를 이용하여 계속 저어준다. GOD에 의해 glucose가 산화되면서 생성되는 H2O2 를 측정하기 위해 0.6V(vs. Ag/AgCl)의 산화전압을 걸어준다. 전극표면에서는 다음과 같은 반응이 진행된다.
GODox + glucose → GODred + gluconolacton
GODred + O2 → GODox + H2O2
H2O2 → O2 + 2H+ + 2e-
Background가 안정되면 0.25 M의 glucose를 micro-syringe를 이용해서 20μL씩 Injection 한다. (농도는 1mM식 증가한다.) 여기서 Nafion은 GOD를 전극표면에 고정시킬 뿐만 아니라 수소이온과 같은 (+)이온을 잘 통과시킨다. glucose를 1μL씩 injection 한 그래프는 그림 9와 그림 10에 나타나있다. glucose를 20μL씩 넣어줄 때마다 전류의 세기가 증가함을 볼 수 있다. 이 데이터를 가지고 glucose의 농도와 전류의 관계를 그리면 그림 12와 같이 직선 그래프가 된다. glucose를 계속 1mM 씩 넣었지만 용액의 농도가 짙어짐에 따라 GOD의 활성도가 낮아진다.
k1 k2
E+S ↔ ES → E+P
k-1
에서 효소반응 속도를 측정해 보면 속도는 기질농도[S]에 따라 달라지는 것을 알 수 있다. 처음 부분과 같이 농도가 낮은 지역에서는 속도가 기질 농도[S]에 비례함을 보여주는 1차 반응이다. 하지만 농도가 높아짐에 따라 기질 농도에 상관없이 반응하는 0차반응에 가까워진다. 따라서 후반부로 갈수록 전류의 증가폭이 줄어든다. 효소반응에 의해 생성된 기질을 전기화학 반응으로 측정한 전류는 반응 속도와 같다. 그러므로 Michaelis - Menten equation( ) 을 이용해서 Lineweaver-Burk equation ( ) 을 전개하고 1/current & 1/glucose의 농도를 plot해 보았다. 그 결과가 그림 13에 나타나있다. 가 0일때 y절편의 값은 이다. 따라서 1.1102 = 가 나왔고 역수를 취해 =0.9007㎂ 을 얻었다. 값은 임의의 한 점을 대입해서 구한다. 그 결과 = 11.40mM 이 나왔다.
이 실험을 할때 주의할 점이 glucose를 1mM씩 injection 할 때 주위의 전극들을 건드리지 않고 한번에 injection 하는 것이 중요했는데 손의 부주의로 인하여 그래프에 떨림이 측정되었다. 좋은 실험결과가 되려면 의 값이 더 높게 나와서 최대속도의 1/2로 일어나는 반응의 기질농도인 이 더 낮게 측정되었어야 했는데 그렇게 되지 못한것이 아쉬웠다.







































소개글