목차
1. 실험결과
1) 각 반응혼합물에 대학 반응속도의 측정 및 반응 물질의 농도 계산하기
2) 반응차수 m과 n을 구하시오.
3) 위에서 구한 m과 n의 값을 이용하여 반응 1에서 반응6까지의 반응속도상수 k를 구하시오.
4) 반응물의 농도가 반응속도에 미치는 영향에 대해 설명하시오.
5) 농도 외에 반응 속도에 영향을 미치는 요인에는 어떠한 것이 있는지 쓰시오.
2. 토의
1) 각 반응혼합물에 대학 반응속도의 측정 및 반응 물질의 농도 계산하기
2) 반응차수 m과 n을 구하시오.
3) 위에서 구한 m과 n의 값을 이용하여 반응 1에서 반응6까지의 반응속도상수 k를 구하시오.
4) 반응물의 농도가 반응속도에 미치는 영향에 대해 설명하시오.
5) 농도 외에 반응 속도에 영향을 미치는 요인에는 어떠한 것이 있는지 쓰시오.
2. 토의
본문내용
irring 또한 속도에 영향을 미칠 것이다.
2. 토의
이번 실험을 통해서 반응속도 예측에서 아주 중요하고도, 기본적인 시계반응에 대해서 이해 할 수 있었다. 또한 k값을 구하는데 있어서 오차가 적은 것으로 보와 꽤 정확한 실험 이었던 것 같다.
이 반응에서는 요오드 이온은 오직 KI로부터 해리되어 나온다. 또한 SO이온은 (NH)SO 로 부터만 해리된다. 그럼에도 KCl이나 (NH)SO를 첨가한 것은 요오드 이온과 SO이온의 농도를 조절하면서도 그 외의 다른 조건들을 동등하게 맞춰주기 위해서이다.
반응차수 m과 n을 구할 때 약간의 오차가 발생했다. 그 이유는 아마도 각각의 반응에서의 k값이 다르기 때문일 것이다.(실재로는 k값이 일정하지만, 매회 측정 때마다 약간씩 조건이 바뀌기 때문에 오차 아닌 오차가 발생한다.)
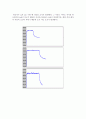
위의 그림을 보면 위,아래로 심하게 요동하는 것을 볼 수 있다, 이는 stirring이 너무 강하여 발생한 빛의 산란에 의한 것이다. 이런 결과를 방지하기위해 화학실험 모듈에서 stirring 속도를 조절해보려 했지만 힘들었다. 기구에 계선의 여지가 필요할 듯하다. (화학실험모듈을 시계반응 측정 외에 어디에 사용할 수 있는지 궁금하다.)
2. 토의
이번 실험을 통해서 반응속도 예측에서 아주 중요하고도, 기본적인 시계반응에 대해서 이해 할 수 있었다. 또한 k값을 구하는데 있어서 오차가 적은 것으로 보와 꽤 정확한 실험 이었던 것 같다.
이 반응에서는 요오드 이온은 오직 KI로부터 해리되어 나온다. 또한 SO이온은 (NH)SO 로 부터만 해리된다. 그럼에도 KCl이나 (NH)SO를 첨가한 것은 요오드 이온과 SO이온의 농도를 조절하면서도 그 외의 다른 조건들을 동등하게 맞춰주기 위해서이다.
반응차수 m과 n을 구할 때 약간의 오차가 발생했다. 그 이유는 아마도 각각의 반응에서의 k값이 다르기 때문일 것이다.(실재로는 k값이 일정하지만, 매회 측정 때마다 약간씩 조건이 바뀌기 때문에 오차 아닌 오차가 발생한다.)
위의 그림을 보면 위,아래로 심하게 요동하는 것을 볼 수 있다, 이는 stirring이 너무 강하여 발생한 빛의 산란에 의한 것이다. 이런 결과를 방지하기위해 화학실험 모듈에서 stirring 속도를 조절해보려 했지만 힘들었다. 기구에 계선의 여지가 필요할 듯하다. (화학실험모듈을 시계반응 측정 외에 어디에 사용할 수 있는지 궁금하다.)
























소개글