목차
1. 실험 제목
2. 실험 목표
3. 실험 이론
4. 실험 순서
5. 실험 결과
6. 참고문헌
2. 실험 목표
3. 실험 이론
4. 실험 순서
5. 실험 결과
6. 참고문헌
본문내용
l를 만들때의 ZnSO4 시료는 9.87g만 있으면 된다
(2) 0.5mol의 CuSO4 제조
CuSO4 분말 역시 5H2O가 포함이 되어 있으므로 정량 몰용액을 만들때
고려해서 제작한다
1M CuSO4 = CuSO4 ·5H2O
(분자량 Cu:63.54, S:32.06, O:16, H:1)
1M CuSO4의 분자량 : {63.54+32.06+(16X4)} + {5X(2+16)} = 249.06g/mol
1ℓ당 g수 : 분자량*몰/ℓ=질량/1ℓ=249.06g/1000㎖
따라서, 1M의 CuSO4 용액 1ℓ를 만들기 위해서는 249.06g의 용질이 필요하다
※ 100ml의 0.5mol의 용액을 만들때의 용질의 g수
시료안에 5H2O를 포함하고 있으므로, 1000ml-90ml=910ml
910ml:100ml=249.06g:x
∴ x=27.37g ← 1mol일때
0.5M의 용액을 만드는 것이므로, 27.37gX0.5=13.68g
따라서, 0.5몰의 용액 100ml를 만들때의 CuSO4 시료는 13.68g만 있으면 된다
3) 전체 반응식
(1) 반쪽반응
Zn(s) → Zn2+(aq) + 2e-
Cu2+(aq) 2e- → Cu(s)
(2) 전체반응
Zn(s)+Cu2+(aq) → Zn2+(aq)+Cu(s)
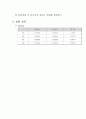
4) 이론값과의 비교
조 별
ZnSO4
CuSO4
기 전 력
이론값
실험값
1조
0.1mol
0.5mol
1.129V
1.04V
2조
0.2mol
0.5mol
1.121V
1.074V
3조
0.3mol
0.5mol
1.112V
1.071V
4조
0.4mol
0.5mol
1.107V
1.067V
5) 상대오차
6) 염다리의 종류와 역할
(1) 염다리의 종류
① U자관에 우묵가사리(한천)과 염(KCl 등)을 넣고 응고시킨 것
② 킴테크 킴와이프스
③ 초벌구이 사기그릇
④ 셀로판종이
(2) 염다리의 역할
염다리는 전류의 이온농도 차이를 일정하게 유지시켜주는 역할을 한다.
화학전지에서 기전력은 양쪽 전극간의 표준전극의 전위차가 되는데,
용액속의 양이온과 음이온의 농도가 변함에 따라서(산화와 환원 때문)
기전력은 급격하게 변화하게 된다.
이 때문에, 염이 건너갈수 있는 통로를 만들어서 이를 염다리라고 하는데,
염다리의 역할은 전류가 흐르도록 이온의 농도를 일정하게 유지시켜주는
역할을 한다.
6. 참고문헌
1) 전지의 과학, Blue Backs, 하시모토 다카시 지음
2) 일반화학, Knneth.W.Whitten, 삼경문화사
(2) 0.5mol의 CuSO4 제조
CuSO4 분말 역시 5H2O가 포함이 되어 있으므로 정량 몰용액을 만들때
고려해서 제작한다
1M CuSO4 = CuSO4 ·5H2O
(분자량 Cu:63.54, S:32.06, O:16, H:1)
1M CuSO4의 분자량 : {63.54+32.06+(16X4)} + {5X(2+16)} = 249.06g/mol
1ℓ당 g수 : 분자량*몰/ℓ=질량/1ℓ=249.06g/1000㎖
따라서, 1M의 CuSO4 용액 1ℓ를 만들기 위해서는 249.06g의 용질이 필요하다
※ 100ml의 0.5mol의 용액을 만들때의 용질의 g수
시료안에 5H2O를 포함하고 있으므로, 1000ml-90ml=910ml
910ml:100ml=249.06g:x
∴ x=27.37g ← 1mol일때
0.5M의 용액을 만드는 것이므로, 27.37gX0.5=13.68g
따라서, 0.5몰의 용액 100ml를 만들때의 CuSO4 시료는 13.68g만 있으면 된다
3) 전체 반응식
(1) 반쪽반응
Zn(s) → Zn2+(aq) + 2e-
Cu2+(aq) 2e- → Cu(s)
(2) 전체반응
Zn(s)+Cu2+(aq) → Zn2+(aq)+Cu(s)
4) 이론값과의 비교
조 별
ZnSO4
CuSO4
기 전 력
이론값
실험값
1조
0.1mol
0.5mol
1.129V
1.04V
2조
0.2mol
0.5mol
1.121V
1.074V
3조
0.3mol
0.5mol
1.112V
1.071V
4조
0.4mol
0.5mol
1.107V
1.067V
5) 상대오차
6) 염다리의 종류와 역할
(1) 염다리의 종류
① U자관에 우묵가사리(한천)과 염(KCl 등)을 넣고 응고시킨 것
② 킴테크 킴와이프스
③ 초벌구이 사기그릇
④ 셀로판종이
(2) 염다리의 역할
염다리는 전류의 이온농도 차이를 일정하게 유지시켜주는 역할을 한다.
화학전지에서 기전력은 양쪽 전극간의 표준전극의 전위차가 되는데,
용액속의 양이온과 음이온의 농도가 변함에 따라서(산화와 환원 때문)
기전력은 급격하게 변화하게 된다.
이 때문에, 염이 건너갈수 있는 통로를 만들어서 이를 염다리라고 하는데,
염다리의 역할은 전류가 흐르도록 이온의 농도를 일정하게 유지시켜주는
역할을 한다.
6. 참고문헌
1) 전지의 과학, Blue Backs, 하시모토 다카시 지음
2) 일반화학, Knneth.W.Whitten, 삼경문화사
추천자료
 열팽창 실험 및 결과
열팽창 실험 및 결과 물리 실험 - 등전위선과 자기장 - 결과 보고서
물리 실험 - 등전위선과 자기장 - 결과 보고서 [물리실험]전하와 전하사이 (쿨롱의 법칙)
[물리실험]전하와 전하사이 (쿨롱의 법칙) 분해전압 실험
분해전압 실험 유체유동 실험(Reynolds number, 손실두 측정)예비보고서
유체유동 실험(Reynolds number, 손실두 측정)예비보고서 일반 물리실험 - 기전력 측정 (전위차계)
일반 물리실험 - 기전력 측정 (전위차계) 자기유도 실험
자기유도 실험 [재료실험] ITO 투명전극재료의 합성 및 물성 평가
[재료실험] ITO 투명전극재료의 합성 및 물성 평가 [일반물리실험]미지의 기전력 측정
[일반물리실험]미지의 기전력 측정 [전기회로실험] Series Circuits 예비보고서
[전기회로실험] Series Circuits 예비보고서 [일반물리학실험] R
[일반물리학실험] R [일반물리실험] 광전효과 현상 - 광전효과 현상을 이해한다. 또한 광전효과 현상을 설명한 광...
[일반물리실험] 광전효과 현상 - 광전효과 현상을 이해한다. 또한 광전효과 현상을 설명한 광... 전위차계 실험보고서
전위차계 실험보고서 물리학 실험 - 옴의 법칙
물리학 실험 - 옴의 법칙


























소개글