목차
실험목적
이 론
실험 결과
이 론
실험 결과
본문내용
의 저항 R은 전극과 전해조의 크기와 모양, 그리고 전해액의 비전도도에 관계되며 전류 I가 미소하다면 Eohm은 (=IR) 무시하는것이 보통이다. Eir은 활성화 분극(Activation Polarization)
, 농도분극(Concentration Polarization) 그리고 전극 표면에 형성된 피막에 관계되는 것이다.
전 해 액 분 해 전 압(V) 전 해 액 분 해 전 압(V) 시안화 구리
1.5
황 산 구 리
1.49
황 산 니 켈
2.09
황 산
1.67
염 화 니 켈
1.85
가성 소오다
1.69
황 산 아 연
2.35
질 산 은
0.70
크 롬 산
2.8
준비물
1. 전압계 (D.C.10V)
2. 전류계 (D.C. 300mA)
3. 백금선
4. 전해액 (황산 1N 용액)
5. 단자
6. Slide 저항
7. 전지
실험 방법
1. 전해액의 제조
1N H2SO4 전해액을 만든다. H2SO4 -49g/증류수 1l
2. 장치
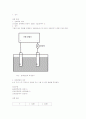
그림과 같이 회로를 연결하고 전해조안에 2개 전극의 전위위치가 변하지 않게 한다.
그림 : 분해전압의 측정장치
3. 분해전압의 측정
0~4V 까지 0.5V 간격으로 전압을 주어 그때 의 전류 변화를 측정한다.
참고문헌
물리화학실험 (동명사)
금속공학실험 (반도출판사)
도금표면처리 (문운당)
실험 결과
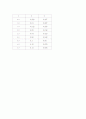
V
I (1차)
I (2차)
0
0
0
0.5
0.009
0.007
1.0
0.01
0.007
1.5
0.012
0.008
2.0
0.02
0.018
2.5
0.04
0.023
3.0
0.08
0.042
3.5
0.1
0.06
4.0
0.12
0.079
4.5
0.11
0.085
, 농도분극(Concentration Polarization) 그리고 전극 표면에 형성된 피막에 관계되는 것이다.
전 해 액 분 해 전 압(V) 전 해 액 분 해 전 압(V) 시안화 구리
1.5
황 산 구 리
1.49
황 산 니 켈
2.09
황 산
1.67
염 화 니 켈
1.85
가성 소오다
1.69
황 산 아 연
2.35
질 산 은
0.70
크 롬 산
2.8
준비물
1. 전압계 (D.C.10V)
2. 전류계 (D.C. 300mA)
3. 백금선
4. 전해액 (황산 1N 용액)
5. 단자
6. Slide 저항
7. 전지
실험 방법
1. 전해액의 제조
1N H2SO4 전해액을 만든다. H2SO4 -49g/증류수 1l
2. 장치
그림과 같이 회로를 연결하고 전해조안에 2개 전극의 전위위치가 변하지 않게 한다.
그림 : 분해전압의 측정장치
3. 분해전압의 측정
0~4V 까지 0.5V 간격으로 전압을 주어 그때 의 전류 변화를 측정한다.
참고문헌
물리화학실험 (동명사)
금속공학실험 (반도출판사)
도금표면처리 (문운당)
실험 결과
V
I (1차)
I (2차)
0
0
0
0.5
0.009
0.007
1.0
0.01
0.007
1.5
0.012
0.008
2.0
0.02
0.018
2.5
0.04
0.023
3.0
0.08
0.042
3.5
0.1
0.06
4.0
0.12
0.079
4.5
0.11
0.085