목차
1. 탄화수소의 분류
2. 알칸(Alkane ; 일반식 CnH2n+2)
3. 알켄 (Alkene : 일반식 CnH2n )
4. 알킨 (Alkyne : 일반식 CnH2n-2 )
5. 시클로알칸(Cycloalkane ; 일반식 CnH2n 또는 (CH2)n N ≥ 3 )
6. 방향족 탄화수소
7. 방향족 탄화수소의 반응성
2. 알칸(Alkane ; 일반식 CnH2n+2)
3. 알켄 (Alkene : 일반식 CnH2n )
4. 알킨 (Alkyne : 일반식 CnH2n-2 )
5. 시클로알칸(Cycloalkane ; 일반식 CnH2n 또는 (CH2)n N ≥ 3 )
6. 방향족 탄화수소
7. 방향족 탄화수소의 반응성
본문내용
모양의 화합물 중 벤젠 핵을 갖고 있는 물질을 방향족 화합물( 芳香族 化合物)이라 하고, 방향족 화합물 중 C와 H만으로 이루어진 화합물을 방향족 탄화수소라 한다. 이들 화학적 성질은 대체로 벤젠과 비슷하다.
벤젠 6개의 탄소 원자가 고리 모양으로 C6H6결합한 가장 간단한 방향족 탄화수소가 벤젠(benzene)이다.
[C6H6의 구조] .
- 6개의 고리 모양으로 결합한 C 원자가 이중 결합을 서로 사이에 둔 것같이 표시하지만, 사실은 6개의 C원자는 모두 조건이다.
- 이중 결합의 위치는 고정되어 있지 않으므로 아래와 같이 널리 쓰고 있다.
- 벤젠핵 벤젠과 같은 고리 모양의 구조를 벤젠핵(benzene 核)이라 한다.
※ 케클레(Kekute,von S.F.A)도이칠란드의 유기 화학자로서, 1865년 벤젠의 구조를 바탕으로 하여 정육각형 고리 모양의 구조를 생각해 내었다.
[벤젠의 분자 구조(sp2, σ.π결합 ) ]
벤젠이 불포화 탄화수소와 다른 독특한 전자 구조를 갖는 것을 강조할 필요가 있다. 실제로 벤제은 탄소 원자의 4개의 원자 가전자 중 3개는 단일 결합에서 쓰이고 나머지 1개의 전자는 모든 탄소 원자들 사이를 자유로이 돌아 다닌다. 그러므로 모든 탄소-탄소 원자간의 결합은 동등하며 단일 결합과 이중결합의 중간인 1.5결합을 이루고 있다
벤젠과 유사한 고리 구조를 갖는 탄화수소를 방향족 탄화수소하고 한다.
벤젠의 결합과 구조를 혼성 오비탈로 설명할 수 있다. 벤젠 분자의 탄소 원자는 sp2혼성 오비탈을 사용하여 2개의 탄소 원자 및 1개의 수소원자와 σ결합을 형성하여 정육각형의 고리를 만든다.
각 탄소 원자에는 혼성에 참여하지 않은 2p오비탈이 하나씩 남아 있다. 이 6개의 2p오비탈은 분자 평면에 수직이며, 이들이 서로 겹쳐서 π결합을 형성한다
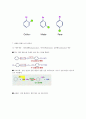
[벤젠의 제법]
코울타르의 분류 및 에틴에 니켈 착염을 촉매로 하여 3분자 중합에 의해 얻을 수 있으나, 공업적으로는 석유를 리포오밍하여 대량 생산하고 있다.
3CH≡CH-->C6H6
C6H14----->C6H6 + 4H2
핵산(석유의 성분)
[ 벤젠 핵을 갖고 있는 물질 (방향족 화합물)의 특징]
(1) 벤젠 핵의 구조는 화학적으로 안정하다.
(2) 구조가 안정하므로 에텐 족에서 와 같은 첨가 반응이 쉽게 일어나지 않는다.
(3) 벤젠 핵에 결합되어 있는 H원자는 할로겐이나 다른 작용기와 치환하기 쉽다.
(4) 이와 같은 치환 원자나 작용기의 특징이 곧 방향족 화합물의 성질이 된다.
(5) 두 가지 이상의 H원자가 치환되면 그 치환 위치에 따라 이성질체가 생긴다.
2치환의 경우에는 오르토(ortho-:o-), 메타(meta: m-), 파라(para: P-)의 이성질체가 있다.
7. 방향족 탄화수소의 반응성
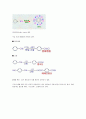
(1) 치환 반응 . 할로겐화(halogenation), 니트로화(nitration), 술폰화(sulfonation) 반응
■ 염소 치환 철(Fe)을 촉매로 하여 염소 Cl2를 통한다.
■ 니트로화 진한 질산과 진한 황산의 혼합 산을 작용시킨다. 여기서 진한 황산은 탈수제로서 작용한다.
■ 술폰화 진한 황산(또는 발연 황산 )을 작용시킨다.
[주] -SO3H는 술폰산기라 하며, 술폰산기가 있는 화합물을 술폰산류라 한다. 술폰산기의 H는 황산이 H와 같아서 술폰산류는 탄소 화합물 중에서 가장 강한 산성을 띤다.
C6H5SO3H → C6H12(시클로핵산)
■ 알킬화
(2) 첨가반응
첨가 반응은 일어나기 어려우나 적당한 조건하에서는 다음과같은 첨가 반응이 일어날 수 있다.
■ 수소첨가 Ni를 촉매로 하여 수소 H2를 작용시킨다.
C6H6 +3H2------> C6H12(시클로핵산)
■ 염소 첨가 햇빛(자외선)을 쬐면서 염소 Cl2를 작용시킨다.
C6H6 + 3Cl2 --> C6H6Cl (Benzene Hexa Chlorde: B.H.C.)
(3)곁사슬(side chain) 반응
사슬 모양 화합물의 반응과 같다.
■ 할로겐화
■ 산화
#벤젠 핵은 첨가 반응보다 치환 반응이 일어나기 쉽다.
구조상 벤젠 핵의 이중 비교적 안정하므로 첨가 반응보다 치환 반응이 일어나기 쉽다. 치환 반응에는 할로겐 차환 . 니트로화 . 술폰화 등이 있다.
명칭
구조
성질
용도
벤젠 [C6H6]
1.무색.방향을 띤 휘발성의 액체
2.물에 불용, 유기물질을 잘 용해
3.H원자는 조건에서는 H2나 CL2를 첨가함(H2는 Ni촉매하에서,Cl는 햇빛에서)
1.용매
2.니트로벤젠. 아닐린.페놀 등 의 합성 원료
톨루엔 [C6H5CH3]
1. 벤젠과 성질이 비슷하다.
2. 산화하면 메틸기는 카르복시기로 변한다.
1.용매,염료,화약등의 원료
2.용매 프탈산류의 제조 원료
크실렌[6H4(CH3)2]
o-xylene
m-xylene
p-xylene
스 티 렌
[C6H5CH=CH2]
1. 끓는점 145의 액체
2.곁 사슬의 비닐기의 이중결합에 의한 첨가반응성이 강하므로 첨가 중합을 하기 쉽다.
폴리스티렌의 합성 원료
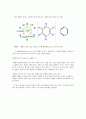
나 프 탈 렌
[C10H8]
1.무색 특유한 냄새를띤 널빤지 모양의 결정으로 승화성이 있다.
2. 방충작용이 있다.
프탈산이나 염료의 합성 원료, 방충제
안 트 라 센
[C14H10]
파란 형광을 띤 널빤지 모양의 결정으로 승화성이 있다.
염료의 합성원료
지방족 탄화수소
방향족 탄화수소
상태
(저급)기체->액체->고체(고급)
방향(芳香)을 띤 액체 또는 결정성 고체
치환
포화 화합물에서만 할로겐화가 일어나고, 이밖에는 치환이 일어나기 어렵다.
1. 할로겐에 의한 할로겐화
2. 진한 질산에 의한 니트로화
3. 술폰화
첨가
1.불포화 화합물에만 할로겐, 할로겐화수소, 물 등이 첨가
2. 불포화 화합물은 Br2, I2 용액을 탈색
1.반응하기 어려우나 조건에 따라 Cl2 등이 첨가
2.벤젠 핵에 의해 Br2, I2용액을 탈색하지 않으나 곁 사슬의 불포화성에 의해 탈색
산화
1.포화 화합물은 산화되기 어렵다.
2.불포화 화합물은 불포화 결합이 있는 곳에서 결합이 있는 곳에서 산화되기 쉽다.
1. 벤젠 핵은 산화되기 어렵다.
2.곁사슬은 산화되어 COOH가 된다.
Table. 지방족 탄화수소와 방향족 탄화수소의 성질 비교
벤젠 6개의 탄소 원자가 고리 모양으로 C6H6결합한 가장 간단한 방향족 탄화수소가 벤젠(benzene)이다.
[C6H6의 구조] .
- 6개의 고리 모양으로 결합한 C 원자가 이중 결합을 서로 사이에 둔 것같이 표시하지만, 사실은 6개의 C원자는 모두 조건이다.
- 이중 결합의 위치는 고정되어 있지 않으므로 아래와 같이 널리 쓰고 있다.
- 벤젠핵 벤젠과 같은 고리 모양의 구조를 벤젠핵(benzene 核)이라 한다.
※ 케클레(Kekute,von S.F.A)도이칠란드의 유기 화학자로서, 1865년 벤젠의 구조를 바탕으로 하여 정육각형 고리 모양의 구조를 생각해 내었다.
[벤젠의 분자 구조(sp2, σ.π결합 ) ]
벤젠이 불포화 탄화수소와 다른 독특한 전자 구조를 갖는 것을 강조할 필요가 있다. 실제로 벤제은 탄소 원자의 4개의 원자 가전자 중 3개는 단일 결합에서 쓰이고 나머지 1개의 전자는 모든 탄소 원자들 사이를 자유로이 돌아 다닌다. 그러므로 모든 탄소-탄소 원자간의 결합은 동등하며 단일 결합과 이중결합의 중간인 1.5결합을 이루고 있다
벤젠과 유사한 고리 구조를 갖는 탄화수소를 방향족 탄화수소하고 한다.
벤젠의 결합과 구조를 혼성 오비탈로 설명할 수 있다. 벤젠 분자의 탄소 원자는 sp2혼성 오비탈을 사용하여 2개의 탄소 원자 및 1개의 수소원자와 σ결합을 형성하여 정육각형의 고리를 만든다.
각 탄소 원자에는 혼성에 참여하지 않은 2p오비탈이 하나씩 남아 있다. 이 6개의 2p오비탈은 분자 평면에 수직이며, 이들이 서로 겹쳐서 π결합을 형성한다
[벤젠의 제법]
코울타르의 분류 및 에틴에 니켈 착염을 촉매로 하여 3분자 중합에 의해 얻을 수 있으나, 공업적으로는 석유를 리포오밍하여 대량 생산하고 있다.
3CH≡CH-->C6H6
C6H14----->C6H6 + 4H2
핵산(석유의 성분)
[ 벤젠 핵을 갖고 있는 물질 (방향족 화합물)의 특징]
(1) 벤젠 핵의 구조는 화학적으로 안정하다.
(2) 구조가 안정하므로 에텐 족에서 와 같은 첨가 반응이 쉽게 일어나지 않는다.
(3) 벤젠 핵에 결합되어 있는 H원자는 할로겐이나 다른 작용기와 치환하기 쉽다.
(4) 이와 같은 치환 원자나 작용기의 특징이 곧 방향족 화합물의 성질이 된다.
(5) 두 가지 이상의 H원자가 치환되면 그 치환 위치에 따라 이성질체가 생긴다.
2치환의 경우에는 오르토(ortho-:o-), 메타(meta: m-), 파라(para: P-)의 이성질체가 있다.
7. 방향족 탄화수소의 반응성
(1) 치환 반응 . 할로겐화(halogenation), 니트로화(nitration), 술폰화(sulfonation) 반응
■ 염소 치환 철(Fe)을 촉매로 하여 염소 Cl2를 통한다.
■ 니트로화 진한 질산과 진한 황산의 혼합 산을 작용시킨다. 여기서 진한 황산은 탈수제로서 작용한다.
■ 술폰화 진한 황산(또는 발연 황산 )을 작용시킨다.
[주] -SO3H는 술폰산기라 하며, 술폰산기가 있는 화합물을 술폰산류라 한다. 술폰산기의 H는 황산이 H와 같아서 술폰산류는 탄소 화합물 중에서 가장 강한 산성을 띤다.
C6H5SO3H → C6H12(시클로핵산)
■ 알킬화
(2) 첨가반응
첨가 반응은 일어나기 어려우나 적당한 조건하에서는 다음과같은 첨가 반응이 일어날 수 있다.
■ 수소첨가 Ni를 촉매로 하여 수소 H2를 작용시킨다.
C6H6 +3H2------> C6H12(시클로핵산)
■ 염소 첨가 햇빛(자외선)을 쬐면서 염소 Cl2를 작용시킨다.
C6H6 + 3Cl2 --> C6H6Cl (Benzene Hexa Chlorde: B.H.C.)
(3)곁사슬(side chain) 반응
사슬 모양 화합물의 반응과 같다.
■ 할로겐화
■ 산화
#벤젠 핵은 첨가 반응보다 치환 반응이 일어나기 쉽다.
구조상 벤젠 핵의 이중 비교적 안정하므로 첨가 반응보다 치환 반응이 일어나기 쉽다. 치환 반응에는 할로겐 차환 . 니트로화 . 술폰화 등이 있다.
명칭
구조
성질
용도
벤젠 [C6H6]
1.무색.방향을 띤 휘발성의 액체
2.물에 불용, 유기물질을 잘 용해
3.H원자는 조건에서는 H2나 CL2를 첨가함(H2는 Ni촉매하에서,Cl는 햇빛에서)
1.용매
2.니트로벤젠. 아닐린.페놀 등 의 합성 원료
톨루엔 [C6H5CH3]
1. 벤젠과 성질이 비슷하다.
2. 산화하면 메틸기는 카르복시기로 변한다.
1.용매,염료,화약등의 원료
2.용매 프탈산류의 제조 원료
크실렌[6H4(CH3)2]
o-xylene
m-xylene
p-xylene
스 티 렌
[C6H5CH=CH2]
1. 끓는점 145의 액체
2.곁 사슬의 비닐기의 이중결합에 의한 첨가반응성이 강하므로 첨가 중합을 하기 쉽다.
폴리스티렌의 합성 원료
나 프 탈 렌
[C10H8]
1.무색 특유한 냄새를띤 널빤지 모양의 결정으로 승화성이 있다.
2. 방충작용이 있다.
프탈산이나 염료의 합성 원료, 방충제
안 트 라 센
[C14H10]
파란 형광을 띤 널빤지 모양의 결정으로 승화성이 있다.
염료의 합성원료
지방족 탄화수소
방향족 탄화수소
상태
(저급)기체->액체->고체(고급)
방향(芳香)을 띤 액체 또는 결정성 고체
치환
포화 화합물에서만 할로겐화가 일어나고, 이밖에는 치환이 일어나기 어렵다.
1. 할로겐에 의한 할로겐화
2. 진한 질산에 의한 니트로화
3. 술폰화
첨가
1.불포화 화합물에만 할로겐, 할로겐화수소, 물 등이 첨가
2. 불포화 화합물은 Br2, I2 용액을 탈색
1.반응하기 어려우나 조건에 따라 Cl2 등이 첨가
2.벤젠 핵에 의해 Br2, I2용액을 탈색하지 않으나 곁 사슬의 불포화성에 의해 탈색
산화
1.포화 화합물은 산화되기 어렵다.
2.불포화 화합물은 불포화 결합이 있는 곳에서 결합이 있는 곳에서 산화되기 쉽다.
1. 벤젠 핵은 산화되기 어렵다.
2.곁사슬은 산화되어 COOH가 된다.
Table. 지방족 탄화수소와 방향족 탄화수소의 성질 비교

































소개글