-
 1
1
-
 2
2
-
 3
3
-
 4
4
-
 5
5
-
 6
6
-
 7
7
-
 8
8
-
 9
9
-
 10
10
-
 11
11
-
 12
12
-
 13
13
-
 14
14
-
 15
15
-
 16
16
-
 17
17
-
 18
18
-
 19
19
-
 20
20
-
 21
21
-
 22
22
-
 23
23
-
 24
24
-
 25
25
-
 26
26
-
 27
27
-
 28
28
-
 29
29
-
 30
30
-
 31
31
-
 32
32
-
 33
33
-
 34
34
-
 35
35
-
 36
36
-
 37
37
-
 38
38
-
 39
39
-
 40
40
-
 41
41
-
 42
42
-
 43
43
-
 44
44
-
 45
45
-
 46
46
-
 47
47
-
 48
48
-
 49
49
-
 50
50
-
 51
51
-
 52
52
-
 53
53
-
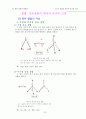 54
54
-
 55
55
-
 56
56
-
 57
57
-
 58
58
-
 59
59
-
 60
60
-
 61
61
-
 62
62
-
 63
63
-
 64
64
-
 65
65
-
 66
66
-
 67
67
-
 68
68
-
 69
69
-
 70
70
-
 71
71
-
 72
72
-
 73
73
-
 74
74
-
 75
75
-
 76
76
-
 77
77
-
 78
78
-
 79
79
-
 80
80
-
 81
81
-
 82
82
-
 83
83
-
 84
84
-
 85
85
-
 86
86
-
 87
87
-
 88
88
-
 89
89
-
 90
90
-
 91
91
-
 92
92
-
 93
93
-
 94
94
-
 95
95
-
 96
96
-
 97
97
-
 98
98
-
 99
99
-
 100
100
-
 101
101
-
 102
102
-
 103
103
-
 104
104
-
 105
105
-
 106
106
-
 107
107
-
 108
108
-
 109
109
-
 110
110
-
 111
111
-
 112
112
-
 113
113
-
 114
114
-
 115
115
-
 116
116
-
 117
117
-
 118
118
-
 119
119
-
 120
120
-
 121
121
-
 122
122
-
 123
123
-
 124
124
-
 125
125
-
 126
126
-
 127
127
-
 128
128
-
 129
129
-
 130
130
-
 131
131
-
 132
132
-
 133
133
-
 134
134
-
 135
135
-
 136
136
-
 137
137
-
 138
138
-
 139
139
-
 140
140
-
 141
141
-
 142
142
-
 143
143
-
 144
144
-
 145
145
-
 146
146
-
 147
147
-
 148
148
-
 149
149
-
 150
150
-
 151
151
-
 152
152
본 자료는 10페이지 의 미리보기를 제공합니다. 이미지를 클릭하여 주세요.

-
1
-
2
-
3
-
4
-
5
-
6
-
7
-
8
-
9
-
10
-
11
-
12
-
13
-
14
-
15
-
16
-
17
-
18
-
19
-
20
-
21
-
22
-
23
-
24
-
25
-
26
-
27
-
28
-
29
-
30
-
31
-
32
-
33
-
34
-
35
-
36
-
37
-
38
-
39
-
40
-
41
-
42
-
43
-
44
-
45
-
46
-
47
-
48
-
49
-
50
-
51
-
52
-
53
-
54
-
55
-
56
-
57
-
58
-
59
-
60
-
61
-
62
-
63
-
64
-
65
-
66
-
67
-
68
-
69
-
70
-
71
-
72
-
73
-
74
-
75
-
76
-
77
-
78
-
79
-
80
-
81
-
82
-
83
-
84
-
85
-
86
-
87
-
88
-
89
-
90
-
91
-
92
-
93
-
94
-
95
-
96
-
97
-
98
-
99
-
100
-
101
-
102
-
103
-
104
-
105
-
106
-
107
-
108
-
109
-
110
-
111
-
112
-
113
-
114
-
115
-
116
-
117
-
118
-
119
-
120
-
121
-
122
-
123
-
124
-
125
-
126
-
127
-
128
-
129
-
130
-
131
-
132
-
133
-
134
-
135
-
136
-
137
-
138
-
139
-
140
-
141
-
142
-
143
-
144
-
145
-
146
-
147
-
148
-
149
-
150
-
151
-
152


목차
Ⅰ. 화학-물질의 과학…1
【1】 물질…1
[1] 물질의 분류…1
[2] 물질의 분리 방법…3
【2】 원자에 관한 법칙…3
[1] 질량 보존의 법칙…3
[2] 일정 성분비의 법칙…4
[3] 배수 비례의 법칙…4
[4] 돌턴의 원자설…5
【3】 분자에 관한 법칙…5
[1] 기체 반응의 법칙…5
[2] 아보가드로의 법칙…6
[3] 기초 법칙과 원자설·분자설…7
【4】 화학식과 화학식량…7
[1] 화학식의 종류…7
[2] 화학식량…10
【5】 화학식량과 화학식 결정…12
[1] 기체 분자량 결정…12
[2] 실험식과 분자식 결정…13
【6】 화학 반응식…15
[1] 화학 반응의 종류…15
[2] 화학 반응식의 완성…15
[3] 화학 반응에서의 양적 관계…17
Ⅱ. 원자의 구조와 주기율…18
【1】 원자의 구조…18
[1] 원자의 구성 입자…18
[2] 원자 모형과 전자 배치…20
[3] 전자 배치의 규칙…23
[4] 전자의 전이와 선스펙트럼…24
【2】 주기율과 주기율표…27
[1] 주기율표…27
[2] 주기율의 정리…31
【3】 같은 족 원소의 성질과 화합물…33
[1] 알칼리 금속…33
[2] 알칼리 토금속…35
[3] 할로겐 원소…36
[4] 비활성 기체…38
【4】 제 2, 3주기 원소의 성질과 화합물…39
[1] 기본 성질…39
[2] 제 2, 3주기 원소의 성질…39
[3] 제 2, 3주기 원소의 화합물…41
[4] 산화물의 종류와 수용액의 성질…42
【5】 전이 원소…43
[1] 전이 원소의 뜻…43
[2] 전이 원소의 성질…43
[3] 착화합물…44
Ⅲ. 화학 결합과 화합물…46
【1】 이온결합…46
[1] 이온 결합의 뜻…46
[2] 이온 결합 물질의 특성…46
[3] 이온 결합 물질의 형성…46
[4] 옥테트 규칙(팔우전자설)…47
【2】 공유결합…48
[1] 공유 결합의 뜻…48
[2] 공유 결합 물질의 특성…48
[3] 공유 결합의 종류…49
[4] 그 밖의 공유 결합…50
【3】 공유결합의 형성과 분자의 모양…51
[1] 공유 결합의 극성…51
[2] 분자의 모양과 오비탈…53
【4】 분자간의 힘…59
[1] 개요…59
[2] 분자간의 힘의 종류와 특성…59
[3] 분자간의 힘과 용해…61
【5】금속 결합…62
[1] 금속 결합의 뜻…62
[2] 금속 결합 물질의 특성…62
[3] 결정의 4가지 형태의 비교…63
【6】 탄소 화합물…64
[1] 탄화수소의 일반적 특성…64
[2] 사슬족 탄화수소의 유도체…71
[3] 방향족 탄화수소…78
[4] 방향족 탄화수소의 유도체…80
[5] 고분자 화합물…83
Ⅳ. 물질의 상태와 용액…90
【1】 상태의 변화와 에너지…90
【2】 기체 상태…93
[1] 보일의 법칙…93
[2] 샤를의 법칙…93
[3] 이상 기체 상태 방정식…94
[4] 기체 분자의 확산 법칙…96
[5] 기체의 분압 법칙…97
【3】 액체 상태…99
[1] 액체에의 끓는점과 증기압…99
[2] 표면 장력…100
[3] 점성도…100
[4] 임계 온도와 임계 압력…100
【4】 고체 상태…101
[1] 결정과 비결정 고체…101
[2] 결정 격자의 종류…101
[3] 고체의 승화와 융해…102
【5】 용해와 용해도…103
[1] 용해와 용액…103
[2] 고체의 용해도…104
[3] 기체의 용해도…106
[4] 용액의 농도…107
【6】 묽은 용액의 성질…110
[1] 묽은 용액의 총괄성…110
[2] 라울의 법칙…110
[3] 삼투 현상…112
【7】 콜로이드의 성질…113
[1] 콜로이드 상태…113
[2] 콜로이드의 성질…113
[3] 기타 콜로이드…115
Ⅴ. 화학반응…116
【1】 화학 반응과 에너지
…116
[1] 반응열…116
[2] 엔탈피…118
[3] 헤스의 법칙…119
【2】 반응열과 화학 반응의 진행…120
[1] 엔탈피의 계산…120
[2] 반응열과 화학 반응의 진행…120
【3】 반응 속도…121
[1] 반응 속도…121
[2] 반응 속도에 미치는 영향…122
[3] 반응 메커니즘…123
【4】 화학 평형…125
[1] 가역·비가역 반응…125
[2] 화학 평형…125
[3] 평형의 이동…126
【5】 산과 염기…128
[1] 산·염기의 정의…128
[2] 산·염기의 성질 비교…129
[3] 산·염기의 세기…129
[4] pH와 중화 적정…131
【6】 염의 가수분해…134
[1] 염의 분류…134
[2] 염의 가수분해와 수용액의 성질…135
[3] 염과 산·염기의 반응…137
【7】 산화와 환원 반응…139
[1] 산화-환원의 뜻…139
[2] 산화수의 계산…139
[3] 산화-환원 반응식…140
【8】 화학 전지와 전기 분해…144
[1] 화학 전지…144
[2] 전기 분해와 그 응용…146
【1】 물질…1
[1] 물질의 분류…1
[2] 물질의 분리 방법…3
【2】 원자에 관한 법칙…3
[1] 질량 보존의 법칙…3
[2] 일정 성분비의 법칙…4
[3] 배수 비례의 법칙…4
[4] 돌턴의 원자설…5
【3】 분자에 관한 법칙…5
[1] 기체 반응의 법칙…5
[2] 아보가드로의 법칙…6
[3] 기초 법칙과 원자설·분자설…7
【4】 화학식과 화학식량…7
[1] 화학식의 종류…7
[2] 화학식량…10
【5】 화학식량과 화학식 결정…12
[1] 기체 분자량 결정…12
[2] 실험식과 분자식 결정…13
【6】 화학 반응식…15
[1] 화학 반응의 종류…15
[2] 화학 반응식의 완성…15
[3] 화학 반응에서의 양적 관계…17
Ⅱ. 원자의 구조와 주기율…18
【1】 원자의 구조…18
[1] 원자의 구성 입자…18
[2] 원자 모형과 전자 배치…20
[3] 전자 배치의 규칙…23
[4] 전자의 전이와 선스펙트럼…24
【2】 주기율과 주기율표…27
[1] 주기율표…27
[2] 주기율의 정리…31
【3】 같은 족 원소의 성질과 화합물…33
[1] 알칼리 금속…33
[2] 알칼리 토금속…35
[3] 할로겐 원소…36
[4] 비활성 기체…38
【4】 제 2, 3주기 원소의 성질과 화합물…39
[1] 기본 성질…39
[2] 제 2, 3주기 원소의 성질…39
[3] 제 2, 3주기 원소의 화합물…41
[4] 산화물의 종류와 수용액의 성질…42
【5】 전이 원소…43
[1] 전이 원소의 뜻…43
[2] 전이 원소의 성질…43
[3] 착화합물…44
Ⅲ. 화학 결합과 화합물…46
【1】 이온결합…46
[1] 이온 결합의 뜻…46
[2] 이온 결합 물질의 특성…46
[3] 이온 결합 물질의 형성…46
[4] 옥테트 규칙(팔우전자설)…47
【2】 공유결합…48
[1] 공유 결합의 뜻…48
[2] 공유 결합 물질의 특성…48
[3] 공유 결합의 종류…49
[4] 그 밖의 공유 결합…50
【3】 공유결합의 형성과 분자의 모양…51
[1] 공유 결합의 극성…51
[2] 분자의 모양과 오비탈…53
【4】 분자간의 힘…59
[1] 개요…59
[2] 분자간의 힘의 종류와 특성…59
[3] 분자간의 힘과 용해…61
【5】금속 결합…62
[1] 금속 결합의 뜻…62
[2] 금속 결합 물질의 특성…62
[3] 결정의 4가지 형태의 비교…63
【6】 탄소 화합물…64
[1] 탄화수소의 일반적 특성…64
[2] 사슬족 탄화수소의 유도체…71
[3] 방향족 탄화수소…78
[4] 방향족 탄화수소의 유도체…80
[5] 고분자 화합물…83
Ⅳ. 물질의 상태와 용액…90
【1】 상태의 변화와 에너지…90
【2】 기체 상태…93
[1] 보일의 법칙…93
[2] 샤를의 법칙…93
[3] 이상 기체 상태 방정식…94
[4] 기체 분자의 확산 법칙…96
[5] 기체의 분압 법칙…97
【3】 액체 상태…99
[1] 액체에의 끓는점과 증기압…99
[2] 표면 장력…100
[3] 점성도…100
[4] 임계 온도와 임계 압력…100
【4】 고체 상태…101
[1] 결정과 비결정 고체…101
[2] 결정 격자의 종류…101
[3] 고체의 승화와 융해…102
【5】 용해와 용해도…103
[1] 용해와 용액…103
[2] 고체의 용해도…104
[3] 기체의 용해도…106
[4] 용액의 농도…107
【6】 묽은 용액의 성질…110
[1] 묽은 용액의 총괄성…110
[2] 라울의 법칙…110
[3] 삼투 현상…112
【7】 콜로이드의 성질…113
[1] 콜로이드 상태…113
[2] 콜로이드의 성질…113
[3] 기타 콜로이드…115
Ⅴ. 화학반응…116
【1】 화학 반응과 에너지
…116
[1] 반응열…116
[2] 엔탈피…118
[3] 헤스의 법칙…119
【2】 반응열과 화학 반응의 진행…120
[1] 엔탈피의 계산…120
[2] 반응열과 화학 반응의 진행…120
【3】 반응 속도…121
[1] 반응 속도…121
[2] 반응 속도에 미치는 영향…122
[3] 반응 메커니즘…123
【4】 화학 평형…125
[1] 가역·비가역 반응…125
[2] 화학 평형…125
[3] 평형의 이동…126
【5】 산과 염기…128
[1] 산·염기의 정의…128
[2] 산·염기의 성질 비교…129
[3] 산·염기의 세기…129
[4] pH와 중화 적정…131
【6】 염의 가수분해…134
[1] 염의 분류…134
[2] 염의 가수분해와 수용액의 성질…135
[3] 염과 산·염기의 반응…137
【7】 산화와 환원 반응…139
[1] 산화-환원의 뜻…139
[2] 산화수의 계산…139
[3] 산화-환원 반응식…140
【8】 화학 전지와 전기 분해…144
[1] 화학 전지…144
[2] 전기 분해와 그 응용…146
본문내용
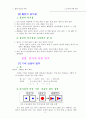
전자쌍 사이의 반발력이 작을수록 안정하기 때문에 될 수 있는 한 반발력이 최소가 되게 전자쌍이 배치된다. 이 전자쌍이 배치된 모양이 물질의 구조 모양이다.
(2) 전자쌍의 수와 분자 구조
전자쌍의 수
분자 구조 모형
결합각
2
직선형
180°
3
평면 삼각형
120°
4
사면체
109.5°
(3) 전자쌍 사이의 반발력이 크기 비교
(공유-공유)전자쌍 < (공유-비공유)전자쌍 < (비공유-비공유)전자쌍
공유 전자쌍은 두 원자가 서로 공유하기 때문에 구속을 받지만 비공유 전자쌍은 그런 구속이 없으므로 반발력이 작용하는 범위가 공유 전자쌍보다 크다.
(4) 정사면체의 변형
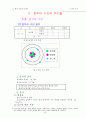
2. 오비탈에 의한 분자 모형
(1) 오비탈 함수의 결합 방식
바닦상태 :
들뜬상태 :
혼성 오비탈
▷의 뜻
탄소의 바닦상태의 전자 배치는 이나 화합물을 이루기 위해서는 들뜬상태인 로 된다. 여기서 원자가전자인 의 전자 4개가 모두 결합에 참여하여 s도 p도 아닌 전혀 다른 새로운 혼성 오비탈 함수를 형성하며 s에서 1개, p에서 3개가 참여하여 만들어진 혼성 오비탈 함수이기 때문에 혼성 오비탈이라 한다.
분자식
점전자식
2s 2p
결합
H
H C H
H
C : ↑ ↑ ↑ ↑
H :
혼성 ↑ ↑ ↑ ↑
단일 결합
O O
O : ↑↓ ↑↓ ↑ ↑
O : ↑↓ ↑↓ ↑ ↑
이중 결합
F F
F : ↑↓ ↑↓ ↑↓ ↑
F : ↑↓ ↑↓ ↑↓ ↑
단일 결합
N N
N : ↑↓ ↑ ↑ ↑
N : ↑↓ ↑ ↑ ↑
삼중 결합
B 바닦상태
들뜬상태
↑↓ ↑
↑ ↑ ↑
단일 결합
F
↑↓ ↑↓ ↑↓ ↑
F B F
F
혼성 ↑ ↑ ↑
(2) 혼성 오비탈 함수와 분자 구조
1) 혼성 오비탈 함수의 뜻
원자와 원자가 결합할 대 두 원자의 궤도 함수가 만나 만든 분자 오비탈 함수로 그 원자 오비탈 함수와는 전혀 다른 새로운 오비탈 함수이다.
2) 혼성 오비탈 함수
2주기 원소가 결합을 할 때는 반드시 들뜬상태에서만 결합을 한다.
함수
개 요
구 조
결합각
s 1개가 만드는 혼성 오비탈 함수
직선 구조
180°
s 1개, p 1개가 만드는 혼성 오비탈 함수
직선 구조
180°
s 1개, p 2개가 만드는 혼성 오비탈 함수
삼각형 구조
120°
s 1개, p 3개가 만드는 혼성 오비탈 함수
사면체 구조
109°
p 1개가 만드는 혼성 오비탈 함수
직선 구조
108°
3) 결합의 종류
A. σ결합
원자 오비탈 함수가 축 방향으로 결합한 것으로 그 단면은 원형을 이루고 있다.
s와 s, s와 p, p와 p 함수 등의 사이에서 사이에서 일어난다.
단일 결합의 경우는 반드시 σ결합이다.
B. π결합
원자 오비탈 함수가 축과 수직한 방향으로 결합한 것으로 그 단면이 아령 모양을 이루고 있다.
반드시 방향성이 있는 오비탈 함수인 p, d, f 사이에서 일어난다.
π결합은 반드시 σ결합이 존재하는 상태에서 이루어지며, σ결합이 π결합보다 안정하기 때문에 에너지를 받으면 π결합이 먼저 끊어진다.
(3) 혼성 오비탈 함수의 예
2주기 원소는 들뜬상태에서 결합이 이루어지며, 3주기 원소는 최외각전자의 에너지가 결합하기에 충분하므로 들뜨지 않고도 결합을 할 수 있다.
1)
1s
s오비탈 1개로 이루어진 결합
분자 오비탈 = s결합
결합각 = 180°
모 양 = 직선형
2)
1s 2s 2p
들뜬상태
2
분자 오비탈 = sp 혼성 오비탈
결합각 = 180°
모 형 = 직선형
3)
1s 2s 2p
들뜬상태
3
분자 오비탈 = 혼성 오비탈
결합각 = 180°
모 형 = 삼각형
4)
1s 2s 2p
들뜬상태
4
분자 오비탈 = 혼성 오비탈
결합각 = 109°
모 형 = 사면체
5)
2s의 1개의 전자쌍은 들뜬상태에서 결합에 참여하나 다른 물질과는 결합을 하지 않는다.
1s 2s 2p
들뜬상태
3
분자 오비탈 = 혼성 오비탈
결합각 = 107°
모 형 = 삼각피라미드
6)
2s, 2p의 2개의 전자쌍은 들뜬상태에서 결합에 참여하나 다른 물질과는 결합을 하지 않는다.
1s 2s 2p
들뜬상태
2
분자 오비탈 = 혼성 오비탈
결합각 = 104.5°
모 형 = 굽은형
7)
1s 2s 2p
분자 오비탈 = p오비탈
결합각 = 180°
모 형 = 직선형
8)
3s 3p
3
분자 오비탈 = 오비탈
결합각 = 93.3°
모 형 = 삼각피라미드
9)
3s 3p
2
분자 오비탈 = 오비탈
결합각 = 92°
모 형 = 굽은형
【4】 분자간의 힘
[1] 개요
1. 분자간의 인력은 그 물질의 특성인 녹는점·끓는점과 용해도에 많은 영향을 미친다.
2. 분자간에 작용하는 힘의 종류가 비슷할수록 용해도가 크다.
3. 분자간의 인력이 클수록 녹는점·끓는점이 높다.
[2] 분자간의 힘의 종류와 특성
1. 쌍극자간의 인력
극성 물질의 사이의 정전기적 인력으로 극성 물질과 극성 물질간의 인력이다.
쌍극자간의 인력은 극성의 크기가 클수록 더 크며, 쌍극자간의 인력이 클수록 분자간의 인력이 커져 녹는점과 끓는점이 높아진다.
2. 수소 결합
(1) 뜻
수소가 있는 극성 물질에서, 인 중심 원소와 인 수소 사이에 작용하는 쌍극자간의 인력이다.
(2) 특성
1) 수소 결합 물질은 분자량이 비슷한 다른 물질보다 끓는점, 녹는점이 높다.
2) 수소 결합 물질의 예
(3) 수소 결합과 물의 특성
1) 분자량이 비슷한 다른 물질에 비해 녹는점·끓는점이 매우 높다.
2) 고체, 액체에서 모두 수소 결합을 한다.
3) 얼음이 물에 뜬다.
얼음은 물분자가 수소 결합을 함으로써 육각형 구조를 이루는데 이 때 육각형 구조 안쪽에 빈 공간이 생기기 때문에 밀도가 작아져 물에 뜬다.
4) 비열이 다른 액체 상태의 물질보다 크다.
3. 분산력
(1) 분산력의 뜻
1) 유발쌍극자
무극성 분자에서 전자가 원자핵 주위를 운동하다가 어느 한 순간 전자들이 한쪽으로 몰려 순간적으로 전자가 한쪽으로 편재될 수가 있다. 이때
(2) 전자쌍의 수와 분자 구조
전자쌍의 수
분자 구조 모형
결합각
2
직선형
180°
3
평면 삼각형
120°
4
사면체
109.5°
(3) 전자쌍 사이의 반발력이 크기 비교
(공유-공유)전자쌍 < (공유-비공유)전자쌍 < (비공유-비공유)전자쌍
공유 전자쌍은 두 원자가 서로 공유하기 때문에 구속을 받지만 비공유 전자쌍은 그런 구속이 없으므로 반발력이 작용하는 범위가 공유 전자쌍보다 크다.
(4) 정사면체의 변형
2. 오비탈에 의한 분자 모형
(1) 오비탈 함수의 결합 방식
바닦상태 :
들뜬상태 :
혼성 오비탈
▷의 뜻
탄소의 바닦상태의 전자 배치는 이나 화합물을 이루기 위해서는 들뜬상태인 로 된다. 여기서 원자가전자인 의 전자 4개가 모두 결합에 참여하여 s도 p도 아닌 전혀 다른 새로운 혼성 오비탈 함수를 형성하며 s에서 1개, p에서 3개가 참여하여 만들어진 혼성 오비탈 함수이기 때문에 혼성 오비탈이라 한다.
분자식
점전자식
2s 2p
결합
H
H C H
H
C : ↑ ↑ ↑ ↑
H :
혼성 ↑ ↑ ↑ ↑
단일 결합
O O
O : ↑↓ ↑↓ ↑ ↑
O : ↑↓ ↑↓ ↑ ↑
이중 결합
F F
F : ↑↓ ↑↓ ↑↓ ↑
F : ↑↓ ↑↓ ↑↓ ↑
단일 결합
N N
N : ↑↓ ↑ ↑ ↑
N : ↑↓ ↑ ↑ ↑
삼중 결합
B 바닦상태
들뜬상태
↑↓ ↑
↑ ↑ ↑
단일 결합
F
↑↓ ↑↓ ↑↓ ↑
F B F
F
혼성 ↑ ↑ ↑
(2) 혼성 오비탈 함수와 분자 구조
1) 혼성 오비탈 함수의 뜻
원자와 원자가 결합할 대 두 원자의 궤도 함수가 만나 만든 분자 오비탈 함수로 그 원자 오비탈 함수와는 전혀 다른 새로운 오비탈 함수이다.
2) 혼성 오비탈 함수
2주기 원소가 결합을 할 때는 반드시 들뜬상태에서만 결합을 한다.
함수
개 요
구 조
결합각
s 1개가 만드는 혼성 오비탈 함수
직선 구조
180°
s 1개, p 1개가 만드는 혼성 오비탈 함수
직선 구조
180°
s 1개, p 2개가 만드는 혼성 오비탈 함수
삼각형 구조
120°
s 1개, p 3개가 만드는 혼성 오비탈 함수
사면체 구조
109°
p 1개가 만드는 혼성 오비탈 함수
직선 구조
108°
3) 결합의 종류
A. σ결합
원자 오비탈 함수가 축 방향으로 결합한 것으로 그 단면은 원형을 이루고 있다.
s와 s, s와 p, p와 p 함수 등의 사이에서 사이에서 일어난다.
단일 결합의 경우는 반드시 σ결합이다.
B. π결합
원자 오비탈 함수가 축과 수직한 방향으로 결합한 것으로 그 단면이 아령 모양을 이루고 있다.
반드시 방향성이 있는 오비탈 함수인 p, d, f 사이에서 일어난다.
π결합은 반드시 σ결합이 존재하는 상태에서 이루어지며, σ결합이 π결합보다 안정하기 때문에 에너지를 받으면 π결합이 먼저 끊어진다.
(3) 혼성 오비탈 함수의 예
2주기 원소는 들뜬상태에서 결합이 이루어지며, 3주기 원소는 최외각전자의 에너지가 결합하기에 충분하므로 들뜨지 않고도 결합을 할 수 있다.
1)
1s
s오비탈 1개로 이루어진 결합
분자 오비탈 = s결합
결합각 = 180°
모 양 = 직선형
2)
1s 2s 2p
들뜬상태
2
분자 오비탈 = sp 혼성 오비탈
결합각 = 180°
모 형 = 직선형
3)
1s 2s 2p
들뜬상태
3
분자 오비탈 = 혼성 오비탈
결합각 = 180°
모 형 = 삼각형
4)
1s 2s 2p
들뜬상태
4
분자 오비탈 = 혼성 오비탈
결합각 = 109°
모 형 = 사면체
5)
2s의 1개의 전자쌍은 들뜬상태에서 결합에 참여하나 다른 물질과는 결합을 하지 않는다.
1s 2s 2p
들뜬상태
3
분자 오비탈 = 혼성 오비탈
결합각 = 107°
모 형 = 삼각피라미드
6)
2s, 2p의 2개의 전자쌍은 들뜬상태에서 결합에 참여하나 다른 물질과는 결합을 하지 않는다.
1s 2s 2p
들뜬상태
2
분자 오비탈 = 혼성 오비탈
결합각 = 104.5°
모 형 = 굽은형
7)
1s 2s 2p
분자 오비탈 = p오비탈
결합각 = 180°
모 형 = 직선형
8)
3s 3p
3
분자 오비탈 = 오비탈
결합각 = 93.3°
모 형 = 삼각피라미드
9)
3s 3p
2
분자 오비탈 = 오비탈
결합각 = 92°
모 형 = 굽은형
【4】 분자간의 힘
[1] 개요
1. 분자간의 인력은 그 물질의 특성인 녹는점·끓는점과 용해도에 많은 영향을 미친다.
2. 분자간에 작용하는 힘의 종류가 비슷할수록 용해도가 크다.
3. 분자간의 인력이 클수록 녹는점·끓는점이 높다.
[2] 분자간의 힘의 종류와 특성
1. 쌍극자간의 인력
극성 물질의 사이의 정전기적 인력으로 극성 물질과 극성 물질간의 인력이다.
쌍극자간의 인력은 극성의 크기가 클수록 더 크며, 쌍극자간의 인력이 클수록 분자간의 인력이 커져 녹는점과 끓는점이 높아진다.
2. 수소 결합
(1) 뜻
수소가 있는 극성 물질에서, 인 중심 원소와 인 수소 사이에 작용하는 쌍극자간의 인력이다.
(2) 특성
1) 수소 결합 물질은 분자량이 비슷한 다른 물질보다 끓는점, 녹는점이 높다.
2) 수소 결합 물질의 예
(3) 수소 결합과 물의 특성
1) 분자량이 비슷한 다른 물질에 비해 녹는점·끓는점이 매우 높다.
2) 고체, 액체에서 모두 수소 결합을 한다.
3) 얼음이 물에 뜬다.
얼음은 물분자가 수소 결합을 함으로써 육각형 구조를 이루는데 이 때 육각형 구조 안쪽에 빈 공간이 생기기 때문에 밀도가 작아져 물에 뜬다.
4) 비열이 다른 액체 상태의 물질보다 크다.
3. 분산력
(1) 분산력의 뜻
1) 유발쌍극자
무극성 분자에서 전자가 원자핵 주위를 운동하다가 어느 한 순간 전자들이 한쪽으로 몰려 순간적으로 전자가 한쪽으로 편재될 수가 있다. 이때


















소개글