목차
Introduction
Material & Reagent
Procedure
result
의문점
Material & Reagent
Procedure
result
의문점
본문내용
서열이 있어 서로를 주형으로 해서 만들어지거나 한 primer내에서 hair pin 구조가 형성되어 생긴 작은 조각이다. 이것은 primer 디자인을 새로 하거나 PCR 최적화를 실시하거나 Touchdown PCR을 실시하면 줄일 수 있다. 또는 3\'에 GC가 많은 경우에 primer는 합성이 시작되는 3\'에 먼저 붙고 일단은 DNA합성을 시작하는데 이 경우보다는 5\'쪽에 GC를 높게 두어 5\'이 먼저 template에 붙은 후 3\'이 붙도록 primer를 디자인하면 primer dimer도 많이 줄일 수 있을 뿐만 아니라 specificity도 높일 수 있다.
그러나 Primer dimer가 있다고 specific band가 없어지는 것은 아니기 때문에 원하는 band가 나오지 않은 것은 primer나 또는 template의 문제로 생각된다. PCR에서 원하는 band는 없더라도 primer dimer가 나온 것은 최소한 Taq이나 PCR은 정상적인 것을 의미하기 때문이다.
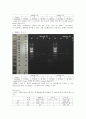
의문점 3 . 왜 sample 10의 B primer를 넣은 lane이 pcr 증폭 후보다 제한효소 처리 후에 더 밴드가 밝아졌는가?
sample 14의 B lane은 pcr 증폭 후에는 A lane보다 밝기가 희미했는데 제한효소 처리 후에는 두 lane의 밝기가 비슷해졌다. 분명 PCR 후 동일한 양을 취하여 하나는 전기영동하고 다른 하나는 제한효소를 처리한 후에 전기영동을 하였다. 물론 각각의 사진은 다른 환경에서 촬영한 것이라 사진만을 가지고 비교를 할 수 없지만 B lane을 A lane과 비교해 봤을 때 육안으로 확인할 수 있을만큼 밝아졌다.
그 이유를 추측해보면 제한효소 처리 후 gel에 loading할 때 A lane이 B lane으로 새었을 수도 있다. A lane과 B lane의 band 위치는 동일하기 때문에 넘어가도 티가 안날 수 있다. 또는 애초에 다른 양을 취하여 loading 했을 수도 있다. 허나 동일한 pipet을 사용하여 한번에 했기 때문에 이건 가능성이 낮다.
의문점 4. sample 10을 O형이라 가정할 경우, 왜 저렇게 나왔을까?
sample 10 채취자는 자신의 혈액형을 O형이라 알고 있었다. 만약 그것이 맞다면 실험이 잘못된 것인데, B lane의 band는 나오면 안되는 게 나온 것이다. 그 이유를 몇 가지 추측해보았다.
추측 1) A lane 내용물이 B lane에 들어간 것이다
하지만 B lane은 PCR 증폭 후에도 나타나고 제한효소 처리 후에도 나타나기 때문에 두 다 A lane 내용물이 들어간 거라고는 보기 어렵다
추측 2) B-R primer가 비특이적 결합을 했다.
A-R primer와 B-R primer는 마지막 한 염기 차이로 똑같다. 그래서 B-R primer가 비특이적 결합을 했다고 추측해봤지만 만약 그랬을 경우 이 실험은 특이성이 떨어져 실험 자체가 잘못된 것이라고 할 수 있다. 즉 A-R와 B-R이 구분이 안된다면 할 필요가 없는 실험인 것이다. 그리고 다들 똑같은 조건에서 PCR을 했기 때문에 우리조만 비특이적 결합을 했다고 보긴 힘들다.
이번 실험은 blood를 쓰지 않고 구강세포를 사용한데다가 PCR 증폭 후 정제를 하지 않아 좋은 결과가 나오지 못한 거 같다. 그러니 다음번에는 검체로 blood를 사용하고 PCR 증폭 후 정제를 하고 전기영동 환경을 조정하여 50V로 25분에 관찰을 하고 또 전기영동을 하여 관찰하다면 좋은 결과를 얻을 수 있을 것이다.
Reference
http://blog.naver.com/rksaadi/30044682660
진단분자생물학. 강희규, 이전종, 정병균, 주세익 외 공저, 23과
그러나 Primer dimer가 있다고 specific band가 없어지는 것은 아니기 때문에 원하는 band가 나오지 않은 것은 primer나 또는 template의 문제로 생각된다. PCR에서 원하는 band는 없더라도 primer dimer가 나온 것은 최소한 Taq이나 PCR은 정상적인 것을 의미하기 때문이다.
의문점 3 . 왜 sample 10의 B primer를 넣은 lane이 pcr 증폭 후보다 제한효소 처리 후에 더 밴드가 밝아졌는가?
sample 14의 B lane은 pcr 증폭 후에는 A lane보다 밝기가 희미했는데 제한효소 처리 후에는 두 lane의 밝기가 비슷해졌다. 분명 PCR 후 동일한 양을 취하여 하나는 전기영동하고 다른 하나는 제한효소를 처리한 후에 전기영동을 하였다. 물론 각각의 사진은 다른 환경에서 촬영한 것이라 사진만을 가지고 비교를 할 수 없지만 B lane을 A lane과 비교해 봤을 때 육안으로 확인할 수 있을만큼 밝아졌다.
그 이유를 추측해보면 제한효소 처리 후 gel에 loading할 때 A lane이 B lane으로 새었을 수도 있다. A lane과 B lane의 band 위치는 동일하기 때문에 넘어가도 티가 안날 수 있다. 또는 애초에 다른 양을 취하여 loading 했을 수도 있다. 허나 동일한 pipet을 사용하여 한번에 했기 때문에 이건 가능성이 낮다.
의문점 4. sample 10을 O형이라 가정할 경우, 왜 저렇게 나왔을까?
sample 10 채취자는 자신의 혈액형을 O형이라 알고 있었다. 만약 그것이 맞다면 실험이 잘못된 것인데, B lane의 band는 나오면 안되는 게 나온 것이다. 그 이유를 몇 가지 추측해보았다.
추측 1) A lane 내용물이 B lane에 들어간 것이다
하지만 B lane은 PCR 증폭 후에도 나타나고 제한효소 처리 후에도 나타나기 때문에 두 다 A lane 내용물이 들어간 거라고는 보기 어렵다
추측 2) B-R primer가 비특이적 결합을 했다.
A-R primer와 B-R primer는 마지막 한 염기 차이로 똑같다. 그래서 B-R primer가 비특이적 결합을 했다고 추측해봤지만 만약 그랬을 경우 이 실험은 특이성이 떨어져 실험 자체가 잘못된 것이라고 할 수 있다. 즉 A-R와 B-R이 구분이 안된다면 할 필요가 없는 실험인 것이다. 그리고 다들 똑같은 조건에서 PCR을 했기 때문에 우리조만 비특이적 결합을 했다고 보긴 힘들다.
이번 실험은 blood를 쓰지 않고 구강세포를 사용한데다가 PCR 증폭 후 정제를 하지 않아 좋은 결과가 나오지 못한 거 같다. 그러니 다음번에는 검체로 blood를 사용하고 PCR 증폭 후 정제를 하고 전기영동 환경을 조정하여 50V로 25분에 관찰을 하고 또 전기영동을 하여 관찰하다면 좋은 결과를 얻을 수 있을 것이다.
Reference
http://blog.naver.com/rksaadi/30044682660
진단분자생물학. 강희규, 이전종, 정병균, 주세익 외 공저, 23과
추천자료
 논문번역 The Crystal Structure of Nucleoplasmin-Core
논문번역 The Crystal Structure of Nucleoplasmin-Core 논문 번역 Molecular chaperones: assisting assembly in addition to folding
논문 번역 Molecular chaperones: assisting assembly in addition to folding [암논문연구]암에 대해서 그리고 암의 유전적 영향(Inheritance of Cancer - NF, Rb)
[암논문연구]암에 대해서 그리고 암의 유전적 영향(Inheritance of Cancer - NF, Rb) 호흡계 THE RESPIRATORY SYSTEM Chapter 35
호흡계 THE RESPIRATORY SYSTEM Chapter 35 [생리학과] 캡사이신과 들기름 섭취한 쥐의 유영훈련 후 혈청 CPK와 LDH 활성도 변화 (The Ch...
[생리학과] 캡사이신과 들기름 섭취한 쥐의 유영훈련 후 혈청 CPK와 LDH 활성도 변화 (The Ch... ABO 혈액형 판독 (ABO system of blood types & hemolysis)
ABO 혈액형 판독 (ABO system of blood types & hemolysis) [생물학 실험] 진핵생물 DNA isolation 및 genotyping (Isolation of High-Molecular DNA fro...
[생물학 실험] 진핵생물 DNA isolation 및 genotyping (Isolation of High-Molecular DNA fro... [실험조리] 실험조리학 및 실습 “단호박갈비찜”.ppt
[실험조리] 실험조리학 및 실습 “단호박갈비찜”.ppt




























소개글