본문내용
Ascorbic acid 이고, Unknown sample B가 설탕임을 알 수 있다.
Ascorbic acid의 분자식은 C6H8O6이므로 분자량은 6 × (12.011) + 8 × (1.0079) + 6 × (15.999) = 176.123 이다. 실험적으로 구한 분자량과 비교해 보면 이론치에 비해서 실험치가 작게 나오는 것을 알 수 있다. 이것은 ascorbic acid가 해리하기 때문이 아닌가 하고 의심해 볼 수 있다. 그러나 ascorbic acid가 약산이기 때문에 이 정도의 영향을 줄 것이라고는 생각되지 않는다.
설탕의 분자식은 C12H22O11이고, 분자량은 12 × (12.011) + 22 × (1.0079) + 11 × (15.999) = 342.293 이다. 실험적으로 구한 분자량과 비교해 보면 거의 일치하는 것을 알 수 있다.
3) NaCl의 어는점 내림
5.0ml의 물에 0.332g의 NaCl을 용해시켰으므로, 물의 밀도를 1.0g/ml이라고 생각하면, 몰랄농도는 m = (용질의 몰 수) / (용매의 킬로그램 수)
= (용질의 질량)/{(용질의 분자량) × (용매의 킬로그램수)
= 0.332g / {58.443g/mol × (5.0ml × 1.0g/ml × 10-3kg/g) } = 1.1 mol /kg
그런데 NaCl은 물속에서 거의 다 두개의 이온으로 해리한다고 볼 수 있으므로 어는점 내림을 계산할 때는 -Kfm에 2를 곱해주어야 한다. 이는 총괄성이 용질의 성질이 아니라 순전히 몰농도, 즉 입자수에만 관련한 것이기 때문이다.
이 때 어는점 내림 △Tf는 -Kfm × 2 = - (1.86 K kg mol-1) × (1.1 mol kg-1) × 2 = - 4.1 K이다.
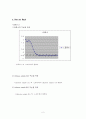
이번 실험에서 증류수가 -0.45℃에서 얼었으므로, NaCl 수용액은 - 4.1 K의 어는점 내림을 고려해 주어서 -5.55℃에서 얼었어야 한다. 그러나 실제로 약 -4.1℃까지 냉각했을 때 NaCl 수용액의 온도가 일정해졌다. 그러나 이론적으로 계산한 어는점보다 높은 온도에서 NaCl 수용액이 얼기 시작했는지는 모르겠다..
4. Reference
① http://147.46.41.146/~chemlab/exp/exp4.htm 참조
② Principles of Modern Chemistry, Oxtoby, Gillis, Nachtrieb, Saunders College Publishing, 1999, p182
Ascorbic acid의 분자식은 C6H8O6이므로 분자량은 6 × (12.011) + 8 × (1.0079) + 6 × (15.999) = 176.123 이다. 실험적으로 구한 분자량과 비교해 보면 이론치에 비해서 실험치가 작게 나오는 것을 알 수 있다. 이것은 ascorbic acid가 해리하기 때문이 아닌가 하고 의심해 볼 수 있다. 그러나 ascorbic acid가 약산이기 때문에 이 정도의 영향을 줄 것이라고는 생각되지 않는다.
설탕의 분자식은 C12H22O11이고, 분자량은 12 × (12.011) + 22 × (1.0079) + 11 × (15.999) = 342.293 이다. 실험적으로 구한 분자량과 비교해 보면 거의 일치하는 것을 알 수 있다.
3) NaCl의 어는점 내림
5.0ml의 물에 0.332g의 NaCl을 용해시켰으므로, 물의 밀도를 1.0g/ml이라고 생각하면, 몰랄농도는 m = (용질의 몰 수) / (용매의 킬로그램 수)
= (용질의 질량)/{(용질의 분자량) × (용매의 킬로그램수)
= 0.332g / {58.443g/mol × (5.0ml × 1.0g/ml × 10-3kg/g) } = 1.1 mol /kg
그런데 NaCl은 물속에서 거의 다 두개의 이온으로 해리한다고 볼 수 있으므로 어는점 내림을 계산할 때는 -Kfm에 2를 곱해주어야 한다. 이는 총괄성이 용질의 성질이 아니라 순전히 몰농도, 즉 입자수에만 관련한 것이기 때문이다.
이 때 어는점 내림 △Tf는 -Kfm × 2 = - (1.86 K kg mol-1) × (1.1 mol kg-1) × 2 = - 4.1 K이다.
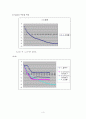
이번 실험에서 증류수가 -0.45℃에서 얼었으므로, NaCl 수용액은 - 4.1 K의 어는점 내림을 고려해 주어서 -5.55℃에서 얼었어야 한다. 그러나 실제로 약 -4.1℃까지 냉각했을 때 NaCl 수용액의 온도가 일정해졌다. 그러나 이론적으로 계산한 어는점보다 높은 온도에서 NaCl 수용액이 얼기 시작했는지는 모르겠다..
4. Reference
① http://147.46.41.146/~chemlab/exp/exp4.htm 참조
② Principles of Modern Chemistry, Oxtoby, Gillis, Nachtrieb, Saunders College Publishing, 1999, p182

























소개글