목차
1.실험제목
2.실험목적
3.서론 및 정리
4.시약 및 기구
5.실험 방법
6.결과
7.고찰
2.실험목적
3.서론 및 정리
4.시약 및 기구
5.실험 방법
6.결과
7.고찰
본문내용
43
2.2
0.3
19.8
8.5
1
38
5.0
2
45
2.0
0.7
20.5
8.1
0.5
38.5
4.2
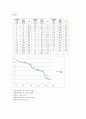
-첫번째 완충구간: 10ml~17ml
-두번째 완충구간: 27ml~33ml
-종말점: 21ml, pH 7.7
-세번째 완충구간: 41.5ml~43ml
-종말점: 38.5ml, pH 4.2
7.고찰
2) 첫 번째 완충영역과 두 번째 완충 영역에서 완충 작용이 최대인 pH를 탄산의 pKa2와 pKa1의 값과 비교해 보아라
6.35와 10.33이 탄산의 pka 값이다. pH값은 이 사이에 위치한다.
3)첫번째 종말점까지 적정하면서 대기 중 이산화탄소가 용액으로 녹아 들어가는 효과는 어떤 영향을 주었는지에 대하여 생각해보아라
이산화탄소는 물에 녹아 산성을 띈다 결국 실제 종말지점보다 HCl을 적게 넣었는데도 종말지점으로 보이게된다.
4)두 번째 종말점까지 들어간 염산 수용액의 부피가 첫 번째 종말점까지 들어간 부피의 두배가 되는가? 아니면 그원인은 어디서 기인한 것일까?
첫 번째 종말점이 21ml이고 두 번째 종말점이 38.5ml이다. 대기중에 이산화탄소가 용액에 녹아 산성을 나타내므로 HCl을 적게 넣어도 종말지점으로 나타나게 된 것이다. 또는 용액내에 HCl이 잘 섞이지 않은 경우 오차가 발생할수도 있다.
5)첫 번째 종말점이 지난 이후에는 대기 중 이산화 탄소가 영향을 미치지 않는 이유는 무엇일까?
첫 번째 종말점이 지나면 더 이상 염기성이 강하지 않기 때문에 이산화 탄소를 강한 압력을 가하지 않는 이상 잘 녹아들어가지 않는다.
6) 완충 작용이 HX와
보통 pH의 변화가 +1과 1 이내이면 완충효과가 크다고 한다.
염기에 의한 pH변화를 억제하려면 HX의 농도가 높아야 하고
산에 의한 pH변화를 억제하려면 X-의 농도가 높아야 하므로
염기와 산 모두에 대해서 완충효과를 잘 나타내려면 둘의 농도가 같아야한다.
공식에서 HX와 의 비가 1이되면 pH=pKa가 되기 때문에 완충작용이 크다.
7)강산이나 강염기로는 완충용액을 만들 수 없는 이유는?
강산이나 강염기는 물속에서 거의 다 이온화 하기 때문에 적정을 하는 즉시 바로 pH가 변하게 된다.
8)일반적인 약산 HX에 대하여 Henderson-Hasselbalch 식을 유도하라.
9)25도씨에서 대기 중에 노출된 물에 녹아 있는 이산화 탄소 CO2의 농도는 1.2*mol/L 정도이다. 이 때 이 물의 pH는 얼마정도인가?
CO2+H2O ->H2CO3
탄산의 Ka = 4.2 * 10^-7
이번 실험은 적정과정을 통해서 적정곡선을 그리고 그 그림에서 당량정 및 완충용액을 알아보는 것이 었다. 그림에서의 나타내는 값과 실제 값은 서로 다를 수있다. 실험과정에서 여러 가지 오차가 발생하였기 때문인데 우선 기계가 아닌 손으로 적정을 하다보니 적정량에서의 오차가 발생하였고 대기중 이산화탄소가 들어가지 않도록하기 위해 빠른 시험을 위해 PH미터를 씻는 과정이 충분치 아니하여서 오차가 발생햇을 가능성이 있다. 하지만 대체로 실제값과 유사하게 나타남으로써 이번 실험은 잘되었던 것 같다.
2.2
0.3
19.8
8.5
1
38
5.0
2
45
2.0
0.7
20.5
8.1
0.5
38.5
4.2
-첫번째 완충구간: 10ml~17ml
-두번째 완충구간: 27ml~33ml
-종말점: 21ml, pH 7.7
-세번째 완충구간: 41.5ml~43ml
-종말점: 38.5ml, pH 4.2
7.고찰
2) 첫 번째 완충영역과 두 번째 완충 영역에서 완충 작용이 최대인 pH를 탄산의 pKa2와 pKa1의 값과 비교해 보아라
6.35와 10.33이 탄산의 pka 값이다. pH값은 이 사이에 위치한다.
3)첫번째 종말점까지 적정하면서 대기 중 이산화탄소가 용액으로 녹아 들어가는 효과는 어떤 영향을 주었는지에 대하여 생각해보아라
이산화탄소는 물에 녹아 산성을 띈다 결국 실제 종말지점보다 HCl을 적게 넣었는데도 종말지점으로 보이게된다.
4)두 번째 종말점까지 들어간 염산 수용액의 부피가 첫 번째 종말점까지 들어간 부피의 두배가 되는가? 아니면 그원인은 어디서 기인한 것일까?
첫 번째 종말점이 21ml이고 두 번째 종말점이 38.5ml이다. 대기중에 이산화탄소가 용액에 녹아 산성을 나타내므로 HCl을 적게 넣어도 종말지점으로 나타나게 된 것이다. 또는 용액내에 HCl이 잘 섞이지 않은 경우 오차가 발생할수도 있다.
5)첫 번째 종말점이 지난 이후에는 대기 중 이산화 탄소가 영향을 미치지 않는 이유는 무엇일까?
첫 번째 종말점이 지나면 더 이상 염기성이 강하지 않기 때문에 이산화 탄소를 강한 압력을 가하지 않는 이상 잘 녹아들어가지 않는다.
6) 완충 작용이 HX와
보통 pH의 변화가 +1과 1 이내이면 완충효과가 크다고 한다.
염기에 의한 pH변화를 억제하려면 HX의 농도가 높아야 하고
산에 의한 pH변화를 억제하려면 X-의 농도가 높아야 하므로
염기와 산 모두에 대해서 완충효과를 잘 나타내려면 둘의 농도가 같아야한다.
공식에서 HX와 의 비가 1이되면 pH=pKa가 되기 때문에 완충작용이 크다.
7)강산이나 강염기로는 완충용액을 만들 수 없는 이유는?
강산이나 강염기는 물속에서 거의 다 이온화 하기 때문에 적정을 하는 즉시 바로 pH가 변하게 된다.
8)일반적인 약산 HX에 대하여 Henderson-Hasselbalch 식을 유도하라.
9)25도씨에서 대기 중에 노출된 물에 녹아 있는 이산화 탄소 CO2의 농도는 1.2*mol/L 정도이다. 이 때 이 물의 pH는 얼마정도인가?
CO2+H2O ->H2CO3
탄산의 Ka = 4.2 * 10^-7
이번 실험은 적정과정을 통해서 적정곡선을 그리고 그 그림에서 당량정 및 완충용액을 알아보는 것이 었다. 그림에서의 나타내는 값과 실제 값은 서로 다를 수있다. 실험과정에서 여러 가지 오차가 발생하였기 때문인데 우선 기계가 아닌 손으로 적정을 하다보니 적정량에서의 오차가 발생하였고 대기중 이산화탄소가 들어가지 않도록하기 위해 빠른 시험을 위해 PH미터를 씻는 과정이 충분치 아니하여서 오차가 발생햇을 가능성이 있다. 하지만 대체로 실제값과 유사하게 나타남으로써 이번 실험은 잘되었던 것 같다.



























소개글