
|
엔트로피. 정음사.
○ 제레미 리프킨. 엔트로피-21세기의 새로운 문명관. 범우사
○ 한영열. 정보이론. 서울 : 民音社. 1985. Ⅰ. 개요
Ⅱ. 엔트로피의 정의
Ⅲ. 엔트로피의 실험 원리
1. 열역학 제1 법칙에 의한 에너지 U와 엔탈피 H에 대한
|
- 페이지 5페이지
- 가격 5,000원
- 등록일 2008.09.02
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|
|
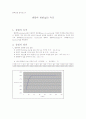
29.3
29.4
29.4
29.4
29.3
29.3
29.3
29.3
29.2
29.2
29.2
※비커의 총 무게 : 204.78 (g)
※ 그 후 5분동안 30초 간격의 온도 (시간단위 : m , 온도단위 : ℃)
시간
0
0.5
1.0
1.5
2.0
2.5
3.0
3.5
4.0
4.5
5.0
온도
29.1
29.0
29.0
29.0
29.0
29.0
29.0
29.0
28.9
28.9
28.9
3. 실험 후 토의
먼저 A
|
- 페이지 6페이지
- 가격 1,500원
- 등록일 2011.10.05
- 파일종류 한글(hwp)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|

|
실험에서 반응한 산과 염기의 농도가 0.1mol로 앞의 두 반응 농도(0.05mol)의 두 배가 되기 때문에 온도도 급격히 높아지고 반응열도 컸던 것이다. 그러나 엔탈피의 변화량을 계산할 때 그렇게 각기 다른 반응열을 몰 수로 나누어 주므로 기준이
|
- 페이지 8페이지
- 가격 1,300원
- 등록일 2008.11.13
- 파일종류 한글(hwp)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|

|
엔트로피 변화가 액체가 고체로 될때 방출하는 열보다 훨씬 작기때문에 △G<0이되어 자발적인(자연 발생적인) 변화가 되는 것이다 .
4. 참고문헌
네이버 검색
일반화학실험/ 김용성외 6 /녹문당 1. 제목
2. 결과
3. 고찰
4. 참고문헌
|
- 페이지 2페이지
- 가격 1,000원
- 등록일 2005.03.21
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
= M'V'(KI2용액)
0.01 * 20.9 = 10 * M'
M' = 0.0209 (M) = b = [I2]aq + [I3-]aq
[I3-]aq = (b - a)/90.5 = 0.02075
[I2]aq = a/90.5 = 0.00015
[I-]aq = 0.2 - (b-a/90.5) = 0.17925
평행상수 K = {(b-a)/90.5}/(a/90.5)(0.2-(b-a)/90.5)
= 771
5. Discussion
이번 실험은 너무 어려운 실험이었다. 실험도 복잡한
|
- 페이지 3페이지
- 가격 600원
- 등록일 2007.12.24
- 파일종류 한글(hwp)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|