목차
1. 제목
2. 실험일자
3. 실험목적
4. 이론적 배경
5. 실험 방법
6. 결과 및 DATA 처리
7. 토의 및 고찰
8. 참고문헌
2. 실험일자
3. 실험목적
4. 이론적 배경
5. 실험 방법
6. 결과 및 DATA 처리
7. 토의 및 고찰
8. 참고문헌
본문내용
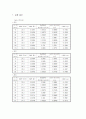
0.5986
-0.5133
13
27.7
0.00554
0.06925
0.58885
-0.5297
21
31.0
0.0062
0.0775
0.5806
-0.5438
29
33.5
0.0067
0.08375
0.57435
-0.5546
37
35.2
0.00704
0.0880
0.5701
-0.5620
45
35.7
0.00714
0.08925
0.56885
-0.5642
53
36.8
0.00736
0.092
0.5661
-0.5691
61
37.3
0.00746
0.09325
0.56485
-0.5713
데이터 값 공식
① NAOH 몰수 = 0.2N × NAOH의 양(L)
② CH3COOH 생성몰수의 농도 : 0.2N × NAOH의 양(ml) = χ × 80(ml)
③ CH3COOCH3의 농도 =
④ 남은 에스테르의 농도 = CH3COOCH3의 농도 - CH3COOH 생성몰수의 농도
몰의 농도는 에스테르의 농도보다 훨씬 크므로, 이 반응은 1차 속도식을 따른다.
( c : 시간 t에서의 에스테르 농도)
( I : 적분 상수)
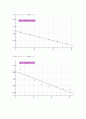
log c 대 t 그래프를 그리면, 주어진 온도에서의 k값을 정할 수 있다.
① 25℃ 일 때, k = -3.030× 10-4
② 35℃ 일 때, k = -6.583× 10-4
③ 45℃ 일 때, k = -9.994× 10-4
위에서 온도에 따른 k 값을 표로 나타내면 다음과 같다.
온 도
25℃(298.15K)
35℃(308.15K)
45℃(318.15K)
k 값
-3.030× 10-4
-6.583× 10-4
-9.994× 10-4
1/T 과 log k값을 표로 나타내면 다음과 같다.
온 도 (1/T)
3.354× 10-3
3.245× 10-3
3.143× 10-3
log k 값
-3.51853
-3.18159
-3.00026
위에서 구한 log k와 1/T의 그래프를 다음 식을 이용하여 도시한다.
여기에서 y절편은 4.7665, 기울기는 -2463.54 이다.
직선의 기울기는 이므로
8. 토의 및 고찰
① 위의 실험 결과를 통해 속도상수 k는 온도에 따라 변한다는 것을 알 수 있다. k는 온 도에 관한 함수이므로 온도측정에 큰 신경을 써야한다.
② 반응시간에 따른 농도 변화식에서 볼 수 있듯이 에스테르의 농도 또한 정확하게 측정 되어야 한다. 위 실험에서 데이터 처리 부분을 보게 되면 초기 에스테르(식초산 메 틸)의 농도는 0.6581mol/l 이고 생성되는 아세트산의 농도는 NaOH의 양에 따라 바뀌 게 된다. 아세트 산이 생성되는 만큼 에스테르(식초산 메틸)의 농도도 점점 줄어들 것이다. 결국 이 실험은 NaOH의 양을 제대로 측정해야만 올바른 실험을 한 것이라 할 수 있다. 일단 NaOH의 양을 잘못 측정하였을 때 k값이 어느 정도 변하는지 알아보겠 다.
반응시간에 따른 농도변화식에서
는 시간 t에서 에스테르 농도이고 는 초기의 에스테르 농도이다.
위 실험에서 는 0.6581mol/l 이라 할 수 있다. 그리고 는
이다.
㉠ NaOH 양을 올바르게 측정하였을 경우
( : 생성된 식초산의 농도 = )
㉡ 여기서 NaOH를 잘못 더하여 측정하였을 경우,
(k' : 측정된 k값)
따라서 반응속도의 참값과 측정값을 대입하여 풀면 NaOH의 오차값을 구할 수 있다.
③ 반응속도상수와 온도의 관계를 나타낸 식의 유도과정은 다음과 같다.
㉠ Arrhenius 식을 사용하면
( A : Arrhenius 상수)
이 식에서 양변에 자연로그를 씌우면 이 되고
이 식을 T에 관해 미분하면
식이 된다.
㉡ Arrhenius 식에서
여기서 양변에 로그를 씌우면 이 되고
이므로
이므로
㉢ 반응시간에 따른 온도변화식을 통해 식을 유도할 수 있다.
( : 시간 t에 따른 에스테르 농도 )
( : 초기농도 )
양변에 자연로그를 소거하면 이고 양변에 다시 로그를 씌우면
양변을 로 나누면
④ 페놀프탈레인 용액은 pH가 염기성일 때 분홍색을 띄는데 산성 용액에 페놀프탈레인을 넣고 염기성 용액(NaOH)을 몇 방울 떨어뜨리게 되면 붉은 빛을 나타냈다가 사라지는 경 우를 볼 수 있다. 이 때는 아직 산성이 강하다는 것을 나타낸다. 염기가 많이 적정될수 록 산과 중화를 이루어져 가고 결국 평형상태까지 도달하게 된다. 이 때를 평형점이라 하는데 무색에서 최소한으로 분홍빛을 띄고 있는 상태를 나타낸다. 분홍빛이 되고나서 30초가 지났는데도 분홍빛이 사라지지 않았다면 그것은 평형점이다. 그리고 그런 것의 이상적인 이론값을 당량점이라고 하는데 당량점은 색이 변하기 전에 다다르게 되고 실 험값으로 얻어지는 값을 종말점이라 한다. 일반적으로 종말점과 계산을 통해 얻어지는 당량점과 가까워야 한다. 그러나 NaOH의 경우 어느 정도 당량점과 종말점으로 차이가 생길 수 밖에 없다. 페놀프탈렌인 용액은 pH가 약 8.5 이상인 염기성일 때 그 색깔이 변한다. 당연히 당량점인 pH 7.0보다 염기성용액인 NaOH 가 더 들어가야 변색범위인 pH 8.5를 넘기 때문에 당량점보다 종말점이 차이가 발생하는 것이다. 즉, pH 차이가 당량 점에서 보다 약 pH 1.5 정도가 염기성쪽으로 치우치도록 NaOH 용액이 더 들어가야 종말 점이 확인된다.
⑤ 에스테르를 실온에서 가수분해 시킬 경우에는 거의 반응이 일어나지 않기 때문에 수소 이온 촉매반응(산촉매 반응)을 통해 활성화 에너지를 낮춤으로써 자신은 거의 변화를 하지 않는 HCl 용액을 사용하였다.
⑥ 온도에 따라 달라지는 반응속도의 예
㉠ 겨울철보다 여름철에 음식이 더 빨리 상한다.
온도와 반응속도를 가정하면 여름에 온도가 높아져 분자운동이 활발해져 온도 10℃ 높아짐에 따라 음식물의 부패 속도는 2배 상승한다. 그래서 여름철에 음식이 더 빨리 상한다.
㉡ 겨울철에 비닐 하우스에서 채소를 재배할 수 있다
겨울철에는 추운데, 비닐하우스는 따뜻한 온도, 즉 높은 온도를 유지해 준다. 그래서 채소를 재배할 수 있도록 채소가 자라는 것을 반응으로 이해한다면, 빨리 자라게 도와 주는 것도 반응속도를 빠르게 해주는 것에 해당함.
9.,참고문헌
물리화학실험 (탐구당) p198~200
물리화학실험 (서문출판사) P182 ~ P185
-0.5133
13
27.7
0.00554
0.06925
0.58885
-0.5297
21
31.0
0.0062
0.0775
0.5806
-0.5438
29
33.5
0.0067
0.08375
0.57435
-0.5546
37
35.2
0.00704
0.0880
0.5701
-0.5620
45
35.7
0.00714
0.08925
0.56885
-0.5642
53
36.8
0.00736
0.092
0.5661
-0.5691
61
37.3
0.00746
0.09325
0.56485
-0.5713
데이터 값 공식
① NAOH 몰수 = 0.2N × NAOH의 양(L)
② CH3COOH 생성몰수의 농도 : 0.2N × NAOH의 양(ml) = χ × 80(ml)
③ CH3COOCH3의 농도 =
④ 남은 에스테르의 농도 = CH3COOCH3의 농도 - CH3COOH 생성몰수의 농도
몰의 농도는 에스테르의 농도보다 훨씬 크므로, 이 반응은 1차 속도식을 따른다.
( c : 시간 t에서의 에스테르 농도)
( I : 적분 상수)
log c 대 t 그래프를 그리면, 주어진 온도에서의 k값을 정할 수 있다.
① 25℃ 일 때, k = -3.030× 10-4
② 35℃ 일 때, k = -6.583× 10-4
③ 45℃ 일 때, k = -9.994× 10-4
위에서 온도에 따른 k 값을 표로 나타내면 다음과 같다.
온 도
25℃(298.15K)
35℃(308.15K)
45℃(318.15K)
k 값
-3.030× 10-4
-6.583× 10-4
-9.994× 10-4
1/T 과 log k값을 표로 나타내면 다음과 같다.
온 도 (1/T)
3.354× 10-3
3.245× 10-3
3.143× 10-3
log k 값
-3.51853
-3.18159
-3.00026
위에서 구한 log k와 1/T의 그래프를 다음 식을 이용하여 도시한다.
여기에서 y절편은 4.7665, 기울기는 -2463.54 이다.
직선의 기울기는 이므로
8. 토의 및 고찰
① 위의 실험 결과를 통해 속도상수 k는 온도에 따라 변한다는 것을 알 수 있다. k는 온 도에 관한 함수이므로 온도측정에 큰 신경을 써야한다.
② 반응시간에 따른 농도 변화식에서 볼 수 있듯이 에스테르의 농도 또한 정확하게 측정 되어야 한다. 위 실험에서 데이터 처리 부분을 보게 되면 초기 에스테르(식초산 메 틸)의 농도는 0.6581mol/l 이고 생성되는 아세트산의 농도는 NaOH의 양에 따라 바뀌 게 된다. 아세트 산이 생성되는 만큼 에스테르(식초산 메틸)의 농도도 점점 줄어들 것이다. 결국 이 실험은 NaOH의 양을 제대로 측정해야만 올바른 실험을 한 것이라 할 수 있다. 일단 NaOH의 양을 잘못 측정하였을 때 k값이 어느 정도 변하는지 알아보겠 다.
반응시간에 따른 농도변화식에서
는 시간 t에서 에스테르 농도이고 는 초기의 에스테르 농도이다.
위 실험에서 는 0.6581mol/l 이라 할 수 있다. 그리고 는
이다.
㉠ NaOH 양을 올바르게 측정하였을 경우
( : 생성된 식초산의 농도 = )
㉡ 여기서 NaOH를 잘못 더하여 측정하였을 경우,
(k' : 측정된 k값)
따라서 반응속도의 참값과 측정값을 대입하여 풀면 NaOH의 오차값을 구할 수 있다.
③ 반응속도상수와 온도의 관계를 나타낸 식의 유도과정은 다음과 같다.
㉠ Arrhenius 식을 사용하면
( A : Arrhenius 상수)
이 식에서 양변에 자연로그를 씌우면 이 되고
이 식을 T에 관해 미분하면
식이 된다.
㉡ Arrhenius 식에서
여기서 양변에 로그를 씌우면 이 되고
이므로
이므로
㉢ 반응시간에 따른 온도변화식을 통해 식을 유도할 수 있다.
( : 시간 t에 따른 에스테르 농도 )
( : 초기농도 )
양변에 자연로그를 소거하면 이고 양변에 다시 로그를 씌우면
양변을 로 나누면
④ 페놀프탈레인 용액은 pH가 염기성일 때 분홍색을 띄는데 산성 용액에 페놀프탈레인을 넣고 염기성 용액(NaOH)을 몇 방울 떨어뜨리게 되면 붉은 빛을 나타냈다가 사라지는 경 우를 볼 수 있다. 이 때는 아직 산성이 강하다는 것을 나타낸다. 염기가 많이 적정될수 록 산과 중화를 이루어져 가고 결국 평형상태까지 도달하게 된다. 이 때를 평형점이라 하는데 무색에서 최소한으로 분홍빛을 띄고 있는 상태를 나타낸다. 분홍빛이 되고나서 30초가 지났는데도 분홍빛이 사라지지 않았다면 그것은 평형점이다. 그리고 그런 것의 이상적인 이론값을 당량점이라고 하는데 당량점은 색이 변하기 전에 다다르게 되고 실 험값으로 얻어지는 값을 종말점이라 한다. 일반적으로 종말점과 계산을 통해 얻어지는 당량점과 가까워야 한다. 그러나 NaOH의 경우 어느 정도 당량점과 종말점으로 차이가 생길 수 밖에 없다. 페놀프탈렌인 용액은 pH가 약 8.5 이상인 염기성일 때 그 색깔이 변한다. 당연히 당량점인 pH 7.0보다 염기성용액인 NaOH 가 더 들어가야 변색범위인 pH 8.5를 넘기 때문에 당량점보다 종말점이 차이가 발생하는 것이다. 즉, pH 차이가 당량 점에서 보다 약 pH 1.5 정도가 염기성쪽으로 치우치도록 NaOH 용액이 더 들어가야 종말 점이 확인된다.
⑤ 에스테르를 실온에서 가수분해 시킬 경우에는 거의 반응이 일어나지 않기 때문에 수소 이온 촉매반응(산촉매 반응)을 통해 활성화 에너지를 낮춤으로써 자신은 거의 변화를 하지 않는 HCl 용액을 사용하였다.
⑥ 온도에 따라 달라지는 반응속도의 예
㉠ 겨울철보다 여름철에 음식이 더 빨리 상한다.
온도와 반응속도를 가정하면 여름에 온도가 높아져 분자운동이 활발해져 온도 10℃ 높아짐에 따라 음식물의 부패 속도는 2배 상승한다. 그래서 여름철에 음식이 더 빨리 상한다.
㉡ 겨울철에 비닐 하우스에서 채소를 재배할 수 있다
겨울철에는 추운데, 비닐하우스는 따뜻한 온도, 즉 높은 온도를 유지해 준다. 그래서 채소를 재배할 수 있도록 채소가 자라는 것을 반응으로 이해한다면, 빨리 자라게 도와 주는 것도 반응속도를 빠르게 해주는 것에 해당함.
9.,참고문헌
물리화학실험 (탐구당) p198~200
물리화학실험 (서문출판사) P182 ~ P185
추천자료
 Hot-wire를 이용한 평균속도와 난류측정
Hot-wire를 이용한 평균속도와 난류측정 평형상수와 속도상수
평형상수와 속도상수 반응공학 설계(연속흐름반응기 series PFR)
반응공학 설계(연속흐름반응기 series PFR) [광합성][광합성 영향요소][광합성 작용 스펙트럼][광합성 명반응과 합성반응]광합성의 개념,...
[광합성][광합성 영향요소][광합성 작용 스펙트럼][광합성 명반응과 합성반응]광합성의 개념,... 운동과 노화 - 행동속도
운동과 노화 - 행동속도 전분의 호화반응과 노화반응
전분의 호화반응과 노화반응 [연소][연소 개념][연소 반응][연소 생성물][연소의 3요소][연소장치][생성물]연소의 개념, ...
[연소][연소 개념][연소 반응][연소 생성물][연소의 3요소][연소장치][생성물]연소의 개념, ... [분자, 분자염증반응, 분자진화론, 분자생물학, 분자유전자지도]분자와 분자염증반응, 분자와...
[분자, 분자염증반응, 분자진화론, 분자생물학, 분자유전자지도]분자와 분자염증반응, 분자와... [인체반응(신체반응), 열, 독소(독성, 독극물), 병원체]열에 대한 인체반응(신체반응), 독소(...
[인체반응(신체반응), 열, 독소(독성, 독극물), 병원체]열에 대한 인체반응(신체반응), 독소(... 루미놀 반응 : 루미놀 반응의 원리를 알고 루미놀 반응을 일으키는 원인 분석 - 이론적 배경,...
루미놀 반응 : 루미놀 반응의 원리를 알고 루미놀 반응을 일으키는 원인 분석 - 이론적 배경,... [식품화학실험] Anthrone reaction 반응 : 탄수화물은 단당류, 이당류, 다당류가 존재하는데 ...
[식품화학실험] Anthrone reaction 반응 : 탄수화물은 단당류, 이당류, 다당류가 존재하는데 ... [식품공학 실험 결과보고서1] Molish 반응 : 탄수화물은 단당류, 이당류, 다당류가 존재하는...
[식품공학 실험 결과보고서1] Molish 반응 : 탄수화물은 단당류, 이당류, 다당류가 존재하는... [화공기초실험] 기체의 확산속도 : 그레이엄(Graham)의 법칙을 이해하고, HCl과 NH4OH를 이용...
[화공기초실험] 기체의 확산속도 : 그레이엄(Graham)의 법칙을 이해하고, HCl과 NH4OH를 이용... [일반화학실험] 평형상수의 결정 : 화학반응이 평형상태에 도달했을 때 평형상태에서 존재하...
[일반화학실험] 평형상수의 결정 : 화학반응이 평형상태에 도달했을 때 평형상태에서 존재하...
































소개글