목차
ABSTRACT
CONTENTS
1. INTRODUCTION
1.1 실험목적
1.2 실험이론
1.3 실험주의사항
1.4 시약의 특성
2. EXPERIMENTAL
2.1 기구 및 시약
2.2 실험절차
3. RESULTS
3.1 Raw data
3.2 Results
4. DISCUSSION
5. REFERENCE
CONTENTS
1. INTRODUCTION
1.1 실험목적
1.2 실험이론
1.3 실험주의사항
1.4 시약의 특성
2. EXPERIMENTAL
2.1 기구 및 시약
2.2 실험절차
3. RESULTS
3.1 Raw data
3.2 Results
4. DISCUSSION
5. REFERENCE
본문내용
ta
반응용기(No)
사용한 NaOH(ml)
1
83
2
70
3
45.5
4
34.5
5
32.3
3.2 Results
Table 4. Results
1
2
3
4
5
반응전 아세트산의 몰수(mol)
0.08734
0.08734
0.08734
0.08734
0.08734
반응전 에탄올의 몰수(mol)
0.01712
0.03425
0.0856
0.1712
0.2568
반응전 물의 몰수(mol)
0.05947
0.05947
0.05947
0.05947
0.05947
평형상태에서 남은 초산의 몰수(mol)
0.08
0.067
0.0425
0.0315
0.0293
평형상태에서 생성된 에틸아세트산의 몰수
7.34×10-3
2.03×10-2
4.48×10-2
5.58×10-2
5.80×10-2
평형상태에서 남은 에탄올의 몰수(mol)
9.78×10-3
1.40×10-2
4.08×10-2
0.115
0.199
평형상태에서 생성된 물의 몰수(mol)
0.0668
0.080
0.104
0.115
0.117
평형상수 K
0.627
1.731
2.88
1.771
1.164
데이터 처리)
①
ex)
② 반응전 물의 몰수(c)
3N HCl 1L중의 물의 몰수=
1ml 중의 물의 몰수=0.05947mol
③ 평형상태에서 남은 초산의 몰수(x)
④ 평형상태에서 생성된 에틸아세트산의 몰수(a-x)
⑤ 평형상태에서 남은 에탄올의 몰수[b-(a-x)]
⑥ 평형상태에서 생성된 물의 몰수[c+(a-x)]
⑦ 평형상수(K)
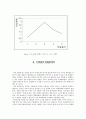
⑧ 평형상수 K vs 반응용기 No 그래프
Figure 1. 방안지에 그린 No. vs K 그래프
Figure 2. Excel을 통해서 그린 No. vs K 그래프
4. DISCUSSION
이번 실험에서는 일정한 농도의 아세트산과 염산에 반응용기마다 농도가 다른 에탄올을 혼합시켜 평형 상태에 도달되었을 때, 평형상태에 있어서의 각 물질의 농도를 구해 평형상수(K)를 구하였다. 실험 결과 일정한 온도에서 같아야 할 평형상수 값이 변하였다. 평형상수는 반응 물질과 생성 물질의 농도가 달라도 온도가 일정하면 항상 일정해야한다. 실온에서 실험을 하였지만 온도가 일정하다고 가정할 수 있으므로 온도의 영향보다는 다른 환경의 영향이 클 것이다.
이번 실험에서는 염산을 사용하는데 염산을 사용하는 이유는 염산이 이 반응의 촉매이기 때문이다. 염산을 가하지 않으면 상온에서 1주간 방치해 두어도 평형상태에 도달하지 않게 된다. 이렇듯 반응속도가 매우 늦기 때문에 적정 중에 평형상태의 변화는 거의 없다. 따라서 이 방법이 가능하게 된다. 또한 촉매를 사용하여도 반응속도가 느리기 때문에 상온에서 일정 시간 방치하여 이 반응이 평형상태에 도달하도록 해야 한다. 만약 반응 속도가 빠르다면 이 방법을 사용할 수 없으므로 다른 물리화학적 측정법을 사용해야만 한다.
반응용기를 제작할 때 시험관의 주둥이 근처를 불꽃으로 가열하여 뽑아 늘여야 하는데 시험관 대신 작은 플라스크를 이용하였다. 작은 플라스크는 필름으로 막아서 사용하였는데 용기안의 기체가 빠져나갔다면 오차가 생겼을 것이다. 하지만 플라스크의 입구가 작고 필름을 여러 겹 사용하였으므로 기체가 빠져나가지 않았을 것이라 가정할 수 있다.
적정을 할 때 정확한 중화점을 찾기 어려운데 이는 페놀프탈레인이 중화점에서는 무색이고 염기가 될 때 색이 변하기 때문이다. 따라서 적정할 때 용액의 색이 변하기 시작할 때부터는 천천히 적정해야 한다. 단 한 방울에 의해서도 색이 많이 변하기 때문이다. 또한 한 방울에서도 어느 정도의 부피가 중화에 사용되었는지 알기 어렵다.
다른 오차의 원인에는 수산화나트륨 용액의 제조에 있다. 수산화나트륨 고체는 조해성이 있어 주위의 수분을 흡수하게 되므로 질량을 측정하는 과정에서 질량이 크게 측정되는 오차가 발생하게 된다. 그리고 수산화나트륨이 유산지에 붙게 되어 측정한 양을 모두 용량플라스크에 넣을 수 없었다. 따라서 오차를 줄이기 위해서는 수산화나트륨의 질량을 측정할 때 최대한 빨리 측정하도록 해야 한다. 하지만 평형상수는 각 성분의 비율에 의해 결정되므로 수산화나트륨 용액을 정확히 1N로 만들지 못했다 하더라도 많은 영향을 미치지는 않을 것이다. 이 때 수산화나트륨 용액이 맞는지 확인해보려면 페놀프탈레인 지시약을 첨가하면 된다. 만일 붉은색으로 변하지 않는다면 수산화나트륨 용액이 아니다.
만일 반응용기의 용액을 알맞게 제조했고 여러 오차의 원인이 평형에 영향을 거의 미치지 못한다 한다면 평형상수에 영향을 줄 수 있는 건 온도밖에 없게 된다. 화학 평형이란 가역 반응에서 조건이 일정할 때 정반응 속도와 역반응 속도가 같아져서 농도 변화가 없는 상태이다. 결과 데이터의 그래프를 보면 아세트산과 에탄올이 같은 비로 반응 했을 때 평형상수 값이 가장 크다. 이 실험에서 평형상수는 온도에 의존하는데 온도가 일정하다 가정할 수 있으므로 이 반응이 가역반응이 아니라는 것을 알 수 있다. 비가역반응에는 기체발생 반응, 앙금생성반응, 산과 염기의 중화반응이 있는데 이 경우에는 중화반응이 해당한다. 아세트산은 산으로 작용하고 에탄올은 염기로 작용하여 중화반응을 하게 된다. 중화반응에 의해 생성된 물 분자는 거의 분해되지 않기 때문에 중화반응은 비가역반응에 해당하게 된다. 따라서 그래프에서 기울기가 0인 직선이 얻어지지 않고 아세트산과 에탄올이 같은 비로 반응했을 때 평형상수 값이 가장 크게 된다.
이번 실험의 궁극적인 목표는 평형상수를 구해봄으로서 산과 염기의 중화반응이 비가역반응이라는 것을 알아보는 것이라 예상된다.
결과 값을 처리하면서 당연히 온도가 일정하므로 평형상수가 일정할 것이라 생각했는데 중화반응이 비가역반응이라 평형상수가 일정하지 않게 된다는 것을 알게 되었다. 비가역반응이란 화학평형이 뚜렷하게 생성계에 치우쳐 있어 역반응이 일어나기 어려운 반응을 말한다.
이번 실험을 통해 평형상수도 직접 구해보고 가역반응과 비가역반응에 대해 자세히 알 수 있어서 유익한 시간이 되었다.
5. REFERENCE
1. H.S.Shin. "Fundamental Chemical Engineering Laboratory Manual" pp.11-13
반응용기(No)
사용한 NaOH(ml)
1
83
2
70
3
45.5
4
34.5
5
32.3
3.2 Results
Table 4. Results
1
2
3
4
5
반응전 아세트산의 몰수(mol)
0.08734
0.08734
0.08734
0.08734
0.08734
반응전 에탄올의 몰수(mol)
0.01712
0.03425
0.0856
0.1712
0.2568
반응전 물의 몰수(mol)
0.05947
0.05947
0.05947
0.05947
0.05947
평형상태에서 남은 초산의 몰수(mol)
0.08
0.067
0.0425
0.0315
0.0293
평형상태에서 생성된 에틸아세트산의 몰수
7.34×10-3
2.03×10-2
4.48×10-2
5.58×10-2
5.80×10-2
평형상태에서 남은 에탄올의 몰수(mol)
9.78×10-3
1.40×10-2
4.08×10-2
0.115
0.199
평형상태에서 생성된 물의 몰수(mol)
0.0668
0.080
0.104
0.115
0.117
평형상수 K
0.627
1.731
2.88
1.771
1.164
데이터 처리)
①
ex)
② 반응전 물의 몰수(c)
3N HCl 1L중의 물의 몰수=
1ml 중의 물의 몰수=0.05947mol
③ 평형상태에서 남은 초산의 몰수(x)
④ 평형상태에서 생성된 에틸아세트산의 몰수(a-x)
⑤ 평형상태에서 남은 에탄올의 몰수[b-(a-x)]
⑥ 평형상태에서 생성된 물의 몰수[c+(a-x)]
⑦ 평형상수(K)
⑧ 평형상수 K vs 반응용기 No 그래프
Figure 1. 방안지에 그린 No. vs K 그래프
Figure 2. Excel을 통해서 그린 No. vs K 그래프
4. DISCUSSION
이번 실험에서는 일정한 농도의 아세트산과 염산에 반응용기마다 농도가 다른 에탄올을 혼합시켜 평형 상태에 도달되었을 때, 평형상태에 있어서의 각 물질의 농도를 구해 평형상수(K)를 구하였다. 실험 결과 일정한 온도에서 같아야 할 평형상수 값이 변하였다. 평형상수는 반응 물질과 생성 물질의 농도가 달라도 온도가 일정하면 항상 일정해야한다. 실온에서 실험을 하였지만 온도가 일정하다고 가정할 수 있으므로 온도의 영향보다는 다른 환경의 영향이 클 것이다.
이번 실험에서는 염산을 사용하는데 염산을 사용하는 이유는 염산이 이 반응의 촉매이기 때문이다. 염산을 가하지 않으면 상온에서 1주간 방치해 두어도 평형상태에 도달하지 않게 된다. 이렇듯 반응속도가 매우 늦기 때문에 적정 중에 평형상태의 변화는 거의 없다. 따라서 이 방법이 가능하게 된다. 또한 촉매를 사용하여도 반응속도가 느리기 때문에 상온에서 일정 시간 방치하여 이 반응이 평형상태에 도달하도록 해야 한다. 만약 반응 속도가 빠르다면 이 방법을 사용할 수 없으므로 다른 물리화학적 측정법을 사용해야만 한다.
반응용기를 제작할 때 시험관의 주둥이 근처를 불꽃으로 가열하여 뽑아 늘여야 하는데 시험관 대신 작은 플라스크를 이용하였다. 작은 플라스크는 필름으로 막아서 사용하였는데 용기안의 기체가 빠져나갔다면 오차가 생겼을 것이다. 하지만 플라스크의 입구가 작고 필름을 여러 겹 사용하였으므로 기체가 빠져나가지 않았을 것이라 가정할 수 있다.
적정을 할 때 정확한 중화점을 찾기 어려운데 이는 페놀프탈레인이 중화점에서는 무색이고 염기가 될 때 색이 변하기 때문이다. 따라서 적정할 때 용액의 색이 변하기 시작할 때부터는 천천히 적정해야 한다. 단 한 방울에 의해서도 색이 많이 변하기 때문이다. 또한 한 방울에서도 어느 정도의 부피가 중화에 사용되었는지 알기 어렵다.
다른 오차의 원인에는 수산화나트륨 용액의 제조에 있다. 수산화나트륨 고체는 조해성이 있어 주위의 수분을 흡수하게 되므로 질량을 측정하는 과정에서 질량이 크게 측정되는 오차가 발생하게 된다. 그리고 수산화나트륨이 유산지에 붙게 되어 측정한 양을 모두 용량플라스크에 넣을 수 없었다. 따라서 오차를 줄이기 위해서는 수산화나트륨의 질량을 측정할 때 최대한 빨리 측정하도록 해야 한다. 하지만 평형상수는 각 성분의 비율에 의해 결정되므로 수산화나트륨 용액을 정확히 1N로 만들지 못했다 하더라도 많은 영향을 미치지는 않을 것이다. 이 때 수산화나트륨 용액이 맞는지 확인해보려면 페놀프탈레인 지시약을 첨가하면 된다. 만일 붉은색으로 변하지 않는다면 수산화나트륨 용액이 아니다.
만일 반응용기의 용액을 알맞게 제조했고 여러 오차의 원인이 평형에 영향을 거의 미치지 못한다 한다면 평형상수에 영향을 줄 수 있는 건 온도밖에 없게 된다. 화학 평형이란 가역 반응에서 조건이 일정할 때 정반응 속도와 역반응 속도가 같아져서 농도 변화가 없는 상태이다. 결과 데이터의 그래프를 보면 아세트산과 에탄올이 같은 비로 반응 했을 때 평형상수 값이 가장 크다. 이 실험에서 평형상수는 온도에 의존하는데 온도가 일정하다 가정할 수 있으므로 이 반응이 가역반응이 아니라는 것을 알 수 있다. 비가역반응에는 기체발생 반응, 앙금생성반응, 산과 염기의 중화반응이 있는데 이 경우에는 중화반응이 해당한다. 아세트산은 산으로 작용하고 에탄올은 염기로 작용하여 중화반응을 하게 된다. 중화반응에 의해 생성된 물 분자는 거의 분해되지 않기 때문에 중화반응은 비가역반응에 해당하게 된다. 따라서 그래프에서 기울기가 0인 직선이 얻어지지 않고 아세트산과 에탄올이 같은 비로 반응했을 때 평형상수 값이 가장 크게 된다.
이번 실험의 궁극적인 목표는 평형상수를 구해봄으로서 산과 염기의 중화반응이 비가역반응이라는 것을 알아보는 것이라 예상된다.
결과 값을 처리하면서 당연히 온도가 일정하므로 평형상수가 일정할 것이라 생각했는데 중화반응이 비가역반응이라 평형상수가 일정하지 않게 된다는 것을 알게 되었다. 비가역반응이란 화학평형이 뚜렷하게 생성계에 치우쳐 있어 역반응이 일어나기 어려운 반응을 말한다.
이번 실험을 통해 평형상수도 직접 구해보고 가역반응과 비가역반응에 대해 자세히 알 수 있어서 유익한 시간이 되었다.
5. REFERENCE
1. H.S.Shin. "Fundamental Chemical Engineering Laboratory Manual" pp.11-13
키워드
추천자료
 [화학실험]유리세공
[화학실험]유리세공 일반화학 실험 보고서(질량측정과 액체 옮기기)
일반화학 실험 보고서(질량측정과 액체 옮기기) 일반화학 실험 - 알코올의 증류
일반화학 실험 - 알코올의 증류 일반화학 및 실험 - 용해열과 과냉각 상태 예비, 결과 리포트
일반화학 및 실험 - 용해열과 과냉각 상태 예비, 결과 리포트 [일반화학실험] 산화-환원 적정 : 과망간산법
[일반화학실험] 산화-환원 적정 : 과망간산법 [일반화학실험] 카페인의 추출과 분리 예비레포트
[일반화학실험] 카페인의 추출과 분리 예비레포트 [분석화학실험]킬레이트적정
[분석화학실험]킬레이트적정 화학공정실험 시계반응
화학공정실험 시계반응  화학 실험보고서 - 기체 상수의 결정
화학 실험보고서 - 기체 상수의 결정 유기공업 화학실험 - Benzene의 Nitration에 의한 Nitrobenzene 합성
유기공업 화학실험 - Benzene의 Nitration에 의한 Nitrobenzene 합성 화학기초실험 - 액체 점도 측정
화학기초실험 - 액체 점도 측정 대기화학 및 실험 - 실내외 이산화탄소(CO2), 온도, 상대습도, 기압 측정을 통한 CO2의 농도보정
대기화학 및 실험 - 실내외 이산화탄소(CO2), 온도, 상대습도, 기압 측정을 통한 CO2의 농도보정 일반화학실험 - 기체상수의 결정
일반화학실험 - 기체상수의 결정 화학化學실험 프리젠테이션(카페인추출)
화학化學실험 프리젠테이션(카페인추출)

































소개글