목차
1. INTRODUCTION
(1) 관련이론 및 관련식
(2) 실험 장치 / 기구 / 시료
(3) 관련 물리상수 및 안전 유의 사항
(4) 노르말 농도
2. EXPERIMENTAL
(1) 실험절차
(2) 실험과정 중에 시도한 변화 내용
(3) 실험 데이터
(4) 관찰사
3. RESULTS & DISCUSSION
(1) 실험 데이터에 대한 결과
(2) 데이터 처리의 예
(3) 데이터 그래프
(4) 실험에 대한 분석
4. REFERENCES
(1) 관련이론 및 관련식
(2) 실험 장치 / 기구 / 시료
(3) 관련 물리상수 및 안전 유의 사항
(4) 노르말 농도
2. EXPERIMENTAL
(1) 실험절차
(2) 실험과정 중에 시도한 변화 내용
(3) 실험 데이터
(4) 관찰사
3. RESULTS & DISCUSSION
(1) 실험 데이터에 대한 결과
(2) 데이터 처리의 예
(3) 데이터 그래프
(4) 실험에 대한 분석
4. REFERENCES
본문내용
.
평형상수가 농도의 영향을 받았다는 것은 위 실험의 내용과 연관지어 분석한다면 어느정도 타당성이 있다고 본다. 하지만 평형상수는 농도의 영향을 받지 않는다.
그렇다면 이 실험은 화학 평형이라는 점을 의심할 수 있따. 화학 평형이란 가역 반응에서 조건이 일정할 때 정반응 속도와 역반응 속도가 같아져서 농도 변화가 없는 상태이다. 그러므로 아무것도 일어나지 않는 것처럼 보이고 동적 평형 상태(미시적 계에서는 끊임없이 정반응과 역반응이 일어나고 있지만, 거시적으로는 두 과정의 반응 속도가 같아서 아무런 변화가 없는 것처럼 보이는 상태) 라고 하는 것이다.
화학 평형이 일어나지 않았다면 이 실험은 가역반응이 아니라는 것을 생각할 수 있다. 그렇다고 가정한다면 평형상수 값이 농도의 영향을 받아 달라지는 것을 설명할 수 있다.
같은 비율의 농도 비로 반응했을 때가 가장 큰 값을 가질 수 있고 그 비의 차가 커질수록 평형상수 값이 작아진다는 것을 알 수 있다.
그렇다면 이 실험이 비가역적인 반응이라는 것을 설명해야 한다.
비가역적인 반응을 보면 기체가 발생하는 반응, 앙금이 생성되는 반응, 산과 염기의 중화반응을 볼 수있다. 이 실험에서 기체 발새과 앙금 생성은 일어나지 않았으므로 제외 시킬 수 있다. 초산은 약산이고 에탄올은 OH기를 포함하고 있는 염기라고 볼 수 있다.
이 실험에서의 반응 생성물을 본다면 물이 생성된다. 중화 반응에 의해 생성된 물 분자는 거의 분해되지 않는다. 그러므로 이 반응은 비가역적인 반응이라고 볼 수 있다.
이것을 받쳐 줄 수 있는 것이 평형상수라고 본다면 충분히 설명할 수 있는 것이다.
다시 생각한다면 이 실험은 처음부터 평형상수를 구하여서 이 반응이 비가역적이라는 사실을 뒷받침할 수 있는 이유는 보여주는 것이라고 볼 수 있다. 그렇기 때문에 농도의 변화에 따른 평형상수의 값이 다르게 나오게 된 것이다.
REFERENCES
1. Gilbert W. Castellan, Physical chemistry 3rd. edition, Benjamin, chapter 32, page pp.799-803, 1983
2. Skoog West Holler, Analytical chemistry 7th edition, 자유아카데미, chapter 7-8, page pp. 139-176
ABSTRACT
균일계의 가역적인 반응이 평형상태에 있을 때 반응에 참여한 물질의 농도사이에는 성립되는 관계식이 성립되고 이 값을 평형상수(equilibrium constant)라고 한다. 이 평형상수는 온도에만 의존하고 농도에는 무관하다. 그렇기 때문에 일정한 온도에서 일어나는 화학반응은 농도에 상관없이 일정한 값을 가져야 한다.
이번 실험은 온도와 압력에 영향을 받지 않는 시료를 사용하여 화학평형이 되었을 때의 농도를 구하여 평형상수를 구하는 실험이다.
평형상수는 르 샤틀리에의 원리에 의한 평형이동과는 관계가 없고 온도만의 상수이기 때문에 가역적인 반응에서의 화학평형이 이루어졌다면 평형상수 값은 일정하게 나와야 한다. 하지만 이 실험에서의 결과는 위와 같이 예상했던 값에서 크게 다른 값이 나왔다.
농도를 다르게 했을 때의 평형상수 값의 편차가 크게 나온 것이다.
실험 중 반응용기의 제작과 평형이 되기 위한 시간이 예상과 다르게 실험을 해서 오차가 나올 것이라고는 예상을 했지만 예상오차보다 크게 나온 것이다.
적정을 통해서 반응용기에 사용된 시료의 농도를 구할 수 있고, 그 농도를 통해서 평형상수를 구할 수 있다. 평형상수는 온도만의 함수이기 때문에 모두 같이 나와야한다.
이 실험에서 온도의 영향을 받지 않게 하지 위해 반응속도가 매우 느린 것을 선택하여 실험 중에 영향을 끼칠 온도의 영향을 받지 않게 했다.
하지만 그 결과는 평형상수의 편차가 크게 나왔다.
그리고 평형상수의 값을 분석한 결과 반응농도 비가 같을 때가 가장 크고 비의 차가 크면 클수록 평형상수 값은 작아지고 있다.
모든 상황을 고려하여 파악할 결과 이 실험은 가역반응이 아니라 비가역반응이라는 결론을 내리게 되었다. 산과 염기의 중화반응처럼 이 반응물의 반응결과 생성된 생성물에서 물이 나왔다. 이렇게 생성된 물은 분해가 잘 되지 않아 한 쪽으로만 진행하는 비가역반응이고 이로인해 구하려고 한 평형상수의 값이 농도에 따라 다르게 나온 것이다.
이 실험을 통해 화학평형을 통해 가역반응과 비가역반응 그리고 평형상수를 이해할 수 있게 되었다. 서로간에 연결된 관계를 충분히 이해함으로써 화학반응의 진행 방향과 영향을 주는 요인들을 알수 있다.
TABLE OF CONTENTS
1. INTRODUCTION ----------------------- 1-3
(1) 관련이론 및 관련식 ------------------------------ 1
(2) 실험 장치 / 기구 / 시료 -------------------------- 1-2
(3) 관련 물리상수 및 안전 유의 사항 ------------------- 2
(4) 노르말 농도 ------------------------------------ 2-3
2. EXPERIMENTAL ----------------------- 4-5
(1) 실험절차 -------------------------------------- 4
(2) 실험과정 중에 시도한 변화 내용 -------------------- 4-5
(3) 실험 데이터 ------------------------------------ 5
(4) 관찰사 ---------------------------------------- 5
3. RESULTS & DISCUSSION --------------- 6-9
(1) 실험 데이터에 대한 결과 -------------------------- 6
(2) 데이터 처리의 예 -------------------------------- 6-7
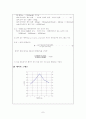
(3) 데이터 그래프 ----------------------------------- 7
(4) 실험에 대한 분석 -------------------------------- 8-9
4. REFERENCES -------------------------- 10
평형상수가 농도의 영향을 받았다는 것은 위 실험의 내용과 연관지어 분석한다면 어느정도 타당성이 있다고 본다. 하지만 평형상수는 농도의 영향을 받지 않는다.
그렇다면 이 실험은 화학 평형이라는 점을 의심할 수 있따. 화학 평형이란 가역 반응에서 조건이 일정할 때 정반응 속도와 역반응 속도가 같아져서 농도 변화가 없는 상태이다. 그러므로 아무것도 일어나지 않는 것처럼 보이고 동적 평형 상태(미시적 계에서는 끊임없이 정반응과 역반응이 일어나고 있지만, 거시적으로는 두 과정의 반응 속도가 같아서 아무런 변화가 없는 것처럼 보이는 상태) 라고 하는 것이다.
화학 평형이 일어나지 않았다면 이 실험은 가역반응이 아니라는 것을 생각할 수 있다. 그렇다고 가정한다면 평형상수 값이 농도의 영향을 받아 달라지는 것을 설명할 수 있다.
같은 비율의 농도 비로 반응했을 때가 가장 큰 값을 가질 수 있고 그 비의 차가 커질수록 평형상수 값이 작아진다는 것을 알 수 있다.
그렇다면 이 실험이 비가역적인 반응이라는 것을 설명해야 한다.
비가역적인 반응을 보면 기체가 발생하는 반응, 앙금이 생성되는 반응, 산과 염기의 중화반응을 볼 수있다. 이 실험에서 기체 발새과 앙금 생성은 일어나지 않았으므로 제외 시킬 수 있다. 초산은 약산이고 에탄올은 OH기를 포함하고 있는 염기라고 볼 수 있다.
이 실험에서의 반응 생성물을 본다면 물이 생성된다. 중화 반응에 의해 생성된 물 분자는 거의 분해되지 않는다. 그러므로 이 반응은 비가역적인 반응이라고 볼 수 있다.
이것을 받쳐 줄 수 있는 것이 평형상수라고 본다면 충분히 설명할 수 있는 것이다.
다시 생각한다면 이 실험은 처음부터 평형상수를 구하여서 이 반응이 비가역적이라는 사실을 뒷받침할 수 있는 이유는 보여주는 것이라고 볼 수 있다. 그렇기 때문에 농도의 변화에 따른 평형상수의 값이 다르게 나오게 된 것이다.
REFERENCES
1. Gilbert W. Castellan, Physical chemistry 3rd. edition, Benjamin, chapter 32, page pp.799-803, 1983
2. Skoog West Holler, Analytical chemistry 7th edition, 자유아카데미, chapter 7-8, page pp. 139-176
ABSTRACT
균일계의 가역적인 반응이 평형상태에 있을 때 반응에 참여한 물질의 농도사이에는 성립되는 관계식이 성립되고 이 값을 평형상수(equilibrium constant)라고 한다. 이 평형상수는 온도에만 의존하고 농도에는 무관하다. 그렇기 때문에 일정한 온도에서 일어나는 화학반응은 농도에 상관없이 일정한 값을 가져야 한다.
이번 실험은 온도와 압력에 영향을 받지 않는 시료를 사용하여 화학평형이 되었을 때의 농도를 구하여 평형상수를 구하는 실험이다.
평형상수는 르 샤틀리에의 원리에 의한 평형이동과는 관계가 없고 온도만의 상수이기 때문에 가역적인 반응에서의 화학평형이 이루어졌다면 평형상수 값은 일정하게 나와야 한다. 하지만 이 실험에서의 결과는 위와 같이 예상했던 값에서 크게 다른 값이 나왔다.
농도를 다르게 했을 때의 평형상수 값의 편차가 크게 나온 것이다.
실험 중 반응용기의 제작과 평형이 되기 위한 시간이 예상과 다르게 실험을 해서 오차가 나올 것이라고는 예상을 했지만 예상오차보다 크게 나온 것이다.
적정을 통해서 반응용기에 사용된 시료의 농도를 구할 수 있고, 그 농도를 통해서 평형상수를 구할 수 있다. 평형상수는 온도만의 함수이기 때문에 모두 같이 나와야한다.
이 실험에서 온도의 영향을 받지 않게 하지 위해 반응속도가 매우 느린 것을 선택하여 실험 중에 영향을 끼칠 온도의 영향을 받지 않게 했다.
하지만 그 결과는 평형상수의 편차가 크게 나왔다.
그리고 평형상수의 값을 분석한 결과 반응농도 비가 같을 때가 가장 크고 비의 차가 크면 클수록 평형상수 값은 작아지고 있다.
모든 상황을 고려하여 파악할 결과 이 실험은 가역반응이 아니라 비가역반응이라는 결론을 내리게 되었다. 산과 염기의 중화반응처럼 이 반응물의 반응결과 생성된 생성물에서 물이 나왔다. 이렇게 생성된 물은 분해가 잘 되지 않아 한 쪽으로만 진행하는 비가역반응이고 이로인해 구하려고 한 평형상수의 값이 농도에 따라 다르게 나온 것이다.
이 실험을 통해 화학평형을 통해 가역반응과 비가역반응 그리고 평형상수를 이해할 수 있게 되었다. 서로간에 연결된 관계를 충분히 이해함으로써 화학반응의 진행 방향과 영향을 주는 요인들을 알수 있다.
TABLE OF CONTENTS
1. INTRODUCTION ----------------------- 1-3
(1) 관련이론 및 관련식 ------------------------------ 1
(2) 실험 장치 / 기구 / 시료 -------------------------- 1-2
(3) 관련 물리상수 및 안전 유의 사항 ------------------- 2
(4) 노르말 농도 ------------------------------------ 2-3
2. EXPERIMENTAL ----------------------- 4-5
(1) 실험절차 -------------------------------------- 4
(2) 실험과정 중에 시도한 변화 내용 -------------------- 4-5
(3) 실험 데이터 ------------------------------------ 5
(4) 관찰사 ---------------------------------------- 5
3. RESULTS & DISCUSSION --------------- 6-9
(1) 실험 데이터에 대한 결과 -------------------------- 6
(2) 데이터 처리의 예 -------------------------------- 6-7
(3) 데이터 그래프 ----------------------------------- 7
(4) 실험에 대한 분석 -------------------------------- 8-9
4. REFERENCES -------------------------- 10
































소개글