목차
1. Gabriel 합성
2. Friedel-Crafts 아실화 반응
3. Friedel-Crafts 알킬화 반응
4. Diels-Alder반응
5. Dieckmann 축합반응
6. Wittig 반응
7. Micheal 반응
8. Williamson 에터 합성
9. Stricker 합성
10. Stock 합성
11. Minnich 반응
12. Kiliani-Fischer 합성
13. Reformatsky 반응
14. Hell-Volhard-Zelinski 반응
15. Kolbe 반응
16. Robinson 고리만듬 반응
17. Claisen 축합반응
18. Wolff-Kishner 반응
19. Koenigs-Knorr 반응
20. Baeyer-Villiger 산화반응
2. Friedel-Crafts 아실화 반응
3. Friedel-Crafts 알킬화 반응
4. Diels-Alder반응
5. Dieckmann 축합반응
6. Wittig 반응
7. Micheal 반응
8. Williamson 에터 합성
9. Stricker 합성
10. Stock 합성
11. Minnich 반응
12. Kiliani-Fischer 합성
13. Reformatsky 반응
14. Hell-Volhard-Zelinski 반응
15. Kolbe 반응
16. Robinson 고리만듬 반응
17. Claisen 축합반응
18. Wolff-Kishner 반응
19. Koenigs-Knorr 반응
20. Baeyer-Villiger 산화반응
본문내용
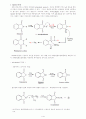
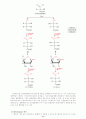
응을 통하여 -할로산을 만든다. 핵심적인 단계는 할로겐화 아실로부터 엔올이 형성되는 단계이다.(카르복실산은 엔올을 쉽게 만들지 못한다) 엔올의 형성은 할로겐화반응이 특별히 -위치에 일어나는 것을 설명해준다. 그리고 -할로산은 다양한 친핵체와 반응할 수 있는 능력을 가졌기 때문에 대단히 중요한 합성의 중간체이다.
< 일반적인 반응>
< 메카니즘 >
< 구체적인 보기 >
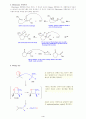
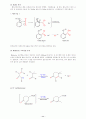
15. Kolbe 반응
펜옥시화이온은 페놀 자체보다더욱 친전자성 방향족 치환반응을 잘 한다. 펜옥시화 이온의 고리의 큰 반응성을 이용한 것이 Kolbe 반응이다. Kolbe 반응에서는 이산화탄소가 친전자체이다.
< 메카니즘 >
살리실산에 아세트산무수물을 반응시키면 아스피린을 합성할수 있다.
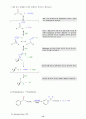
16. Robinson 고리만듦 반응
Robinson 고리만듦 반응의 첫단계는 단순히 Micheal 반응이다. -다이케톤 혹은 -케토 에스터로부터 안정화된 엔올 음이온이 , -불포화 케톤의 이중결합에 콘쥬케이션 첨가되어 1,5-다이케톤이 생성된다. 그리고 다시 이것을 염기처리하여 높은온도에서 계속 반응시키면, 고리 만듦이 완전하게 일어난 고리 화합물이 생성된다.
ex) 2-cyclohexenone
17. Claisen 축합반응
Claisen 축합반응은 알돌메카니즘과 유사하다. 그리고 Claisen 축합반응은 두 번째 에스터 분자의 카보닐기에 에스터 엔올 음이온의 친핵성 아실 첨가가 포함되어있다. 알돌 반응과의 차이점은 단지 처음에 형성된 정사면체형 중간체의 변화과정이다. 알돌반응에서 정사면체 중간체는 양성자가 첨가되어 알코올을 형성하며 Claisen 축합반응은 알콩시드 이탈기를 밀어내고 아실치환반응 생성물을 형성한다는 것이다. 아무튼 두 에스터 성분사이의 반응이란 사실은 변함이 없다.
에톡시드 염기가 에스터 분자로부터 산성의 알파수소를 떼어내고 에스터 엔올 음이온을 생성한다. 생성된 이온이 두 번째 에스터 분자에 친핵성 첨가되어 정사면체형 중간체를 형성한다. 정사면체형 중간체는 불안정하다. 에톡시드 이온을 잃고 새로운 카보닐 화합물인 에틸 아세토 아세테이트를 형성한다. 그러나 에톡시드 이온은 -케토 에스터 생성물을 DRM 엔올 음이온으로 만들 수 있을 만큼 충분한 염기이고 따라서 평형을 이동시킴으로서 반응이 완결되도록 유도한다. 산의 첨가에의한 양성자 첨가반응으로 최종 생성물이 얻어진다.
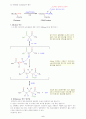
18. Wolff-Kishner 환원반응
독일의 Ludwig Wolff와 러시아의 N.M. Kishner에 의해 각각 독자적으로 연구된 이 반응은 케톤 혹은 알데하이드를 알케인으로, 전환시키는데 매우 중요한 합성법이다. 이 반응은 hyrazone중간체, R2C=NNH2의 형성이포함되어 있고, 이어서 염기-촉매에 의한 이중결합 이동, N2가스 잃음 및 생성물인 알케인이 형성된다. 이중결합의 이동은 염기가 약산성 NH 양전자를 제거하고 hydrazone 음이온이 생길 때 일어난다. 이러한 hydrazone 음이온은 질소와 탄소의 음전하 사이에 이중결합에서 일어나는 알리자리 공명구조를 가지기 때문에 양성자 첨가는 탄소에서 일어나고 이중결합이 이동된 생성물이 얻어진다. 질소를 잃어 버리고 알킬 음이온이 형성된후 양성자 첨가되는 마지막에는 두 번째 단계는 질소분자의 큰 열역학적 안정성 때문에 일어난다.
< 케톤 혹은 알데하이드에서 알케인이 얻어지는 메카니즘>
케톤 혹은 알데하이드와 hydrazine과 반응은 정상적으로 hydrazone을 형성한다.
염기는 -NH2로부터 약한 산성 양성자중에 하나를 떼어내어 hydrazone 음이온을 생성한다. 이 음이온은 탄소의 음전하와 질소의 이중결합 사이에 일어나는 \"알릴자리\"공명구조를 갖는다.
Hydrazone 음이온에 양성자 첨가가 탄소에 일어나고 중성인 중간체가 형성된다.
염기에 의해 질소를 잃어버리고 카르보 음이온이 되며...
...양성자 첨가되어 중성인 알케인 생성물이 형성된다.
ex) Propiophenone → Propylbezene
19. Koenigs-Knorr 반응
흔히 실험실에서 글리코사이드의 합성은 어렵지만, glocuse pentaacetate에 HBr을 가하고 난 후 silver oxide 존재하에서 적당한 알코올을 가함으로서 glucose의 -클리코사이드를 만드는데 가장 적합한 방법이다. 이반응은 pyranosyl bromide의 형성이 포함되어 있고, 이어서친핵성 치환방응이 일어난다.
< 이웃한 아세테이트의 인접-기 효과를 보여주는 Koenigs-Knorr 반응 메카니즘 >
ex) Methlylarbutin 합성
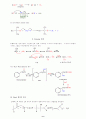
20. Baeyer-Villiger 산화반응
알데히드나 케톤은 둘다 퍼옥시산에의해 산화되어진다. Baeyer-Villiger 산화반응이라 불리는 이반응은 케톤에 대해 아주 유용한 반응인데, 그것은 케톤을 카르복실 에스테르로 변환시키기 때문이다. 예를들어, 아세토페논을 퍼옥시산과 반응시키면 에스테르, 즉 아세트산 페닐로 전환된다.
퍼옥시산은 양성자가 첨가된 카르보닐 반응물을공격한다.
카르보닐 반응물이 산으로부터 양성자를 제거한다.
양성자가 옥소늄이온으로부터 제거된다.
이 중간체에서 퍼옥시산의 카르보닐 그룹에 양서자가 첨가되어 RCO2H부분을 이탈기로 만들어 준다.
페닐그룹이 전자쌍을 가지고 이웃 산소로 이동하며, 동시에 RCO2H가 이탈기로서 떠나간다.
양성자가 제거되어
에스테르 생성물이
얻어진다.
1. Gabriel 합성
2. Friedel-Crafts 아실화 반응
3. Friedel-Crafts 알킬화 반응
4. Diels-Alder반응
5. Dieckmann 축합반응
6. Wittig 반응
7. Micheal 반응
8. Williamson 에터 합성
9. Stricker 합성
10. Stock 합성
11. Minnich 반응
12. Kiliani-Fischer 합성
13. Reformatsky 반응
14. Hell-Volhard-Zelinski 반응
15. Kolbe 반응
16. Robinson 고리만듬 반응
17. Claisen 축합반응
18. Wolff-Kishner 반응
19. Koenigs-Knorr 반응
20. Baeyer-Villiger 산화반응
< 일반적인 반응>
< 메카니즘 >
< 구체적인 보기 >
15. Kolbe 반응
펜옥시화이온은 페놀 자체보다더욱 친전자성 방향족 치환반응을 잘 한다. 펜옥시화 이온의 고리의 큰 반응성을 이용한 것이 Kolbe 반응이다. Kolbe 반응에서는 이산화탄소가 친전자체이다.
< 메카니즘 >
살리실산에 아세트산무수물을 반응시키면 아스피린을 합성할수 있다.
16. Robinson 고리만듦 반응
Robinson 고리만듦 반응의 첫단계는 단순히 Micheal 반응이다. -다이케톤 혹은 -케토 에스터로부터 안정화된 엔올 음이온이 , -불포화 케톤의 이중결합에 콘쥬케이션 첨가되어 1,5-다이케톤이 생성된다. 그리고 다시 이것을 염기처리하여 높은온도에서 계속 반응시키면, 고리 만듦이 완전하게 일어난 고리 화합물이 생성된다.
ex) 2-cyclohexenone
17. Claisen 축합반응
Claisen 축합반응은 알돌메카니즘과 유사하다. 그리고 Claisen 축합반응은 두 번째 에스터 분자의 카보닐기에 에스터 엔올 음이온의 친핵성 아실 첨가가 포함되어있다. 알돌 반응과의 차이점은 단지 처음에 형성된 정사면체형 중간체의 변화과정이다. 알돌반응에서 정사면체 중간체는 양성자가 첨가되어 알코올을 형성하며 Claisen 축합반응은 알콩시드 이탈기를 밀어내고 아실치환반응 생성물을 형성한다는 것이다. 아무튼 두 에스터 성분사이의 반응이란 사실은 변함이 없다.
에톡시드 염기가 에스터 분자로부터 산성의 알파수소를 떼어내고 에스터 엔올 음이온을 생성한다. 생성된 이온이 두 번째 에스터 분자에 친핵성 첨가되어 정사면체형 중간체를 형성한다. 정사면체형 중간체는 불안정하다. 에톡시드 이온을 잃고 새로운 카보닐 화합물인 에틸 아세토 아세테이트를 형성한다. 그러나 에톡시드 이온은 -케토 에스터 생성물을 DRM 엔올 음이온으로 만들 수 있을 만큼 충분한 염기이고 따라서 평형을 이동시킴으로서 반응이 완결되도록 유도한다. 산의 첨가에의한 양성자 첨가반응으로 최종 생성물이 얻어진다.
18. Wolff-Kishner 환원반응
독일의 Ludwig Wolff와 러시아의 N.M. Kishner에 의해 각각 독자적으로 연구된 이 반응은 케톤 혹은 알데하이드를 알케인으로, 전환시키는데 매우 중요한 합성법이다. 이 반응은 hyrazone중간체, R2C=NNH2의 형성이포함되어 있고, 이어서 염기-촉매에 의한 이중결합 이동, N2가스 잃음 및 생성물인 알케인이 형성된다. 이중결합의 이동은 염기가 약산성 NH 양전자를 제거하고 hydrazone 음이온이 생길 때 일어난다. 이러한 hydrazone 음이온은 질소와 탄소의 음전하 사이에 이중결합에서 일어나는 알리자리 공명구조를 가지기 때문에 양성자 첨가는 탄소에서 일어나고 이중결합이 이동된 생성물이 얻어진다. 질소를 잃어 버리고 알킬 음이온이 형성된후 양성자 첨가되는 마지막에는 두 번째 단계는 질소분자의 큰 열역학적 안정성 때문에 일어난다.
< 케톤 혹은 알데하이드에서 알케인이 얻어지는 메카니즘>
케톤 혹은 알데하이드와 hydrazine과 반응은 정상적으로 hydrazone을 형성한다.
염기는 -NH2로부터 약한 산성 양성자중에 하나를 떼어내어 hydrazone 음이온을 생성한다. 이 음이온은 탄소의 음전하와 질소의 이중결합 사이에 일어나는 \"알릴자리\"공명구조를 갖는다.
Hydrazone 음이온에 양성자 첨가가 탄소에 일어나고 중성인 중간체가 형성된다.
염기에 의해 질소를 잃어버리고 카르보 음이온이 되며...
...양성자 첨가되어 중성인 알케인 생성물이 형성된다.
ex) Propiophenone → Propylbezene
19. Koenigs-Knorr 반응
흔히 실험실에서 글리코사이드의 합성은 어렵지만, glocuse pentaacetate에 HBr을 가하고 난 후 silver oxide 존재하에서 적당한 알코올을 가함으로서 glucose의 -클리코사이드를 만드는데 가장 적합한 방법이다. 이반응은 pyranosyl bromide의 형성이 포함되어 있고, 이어서친핵성 치환방응이 일어난다.
< 이웃한 아세테이트의 인접-기 효과를 보여주는 Koenigs-Knorr 반응 메카니즘 >
ex) Methlylarbutin 합성
20. Baeyer-Villiger 산화반응
알데히드나 케톤은 둘다 퍼옥시산에의해 산화되어진다. Baeyer-Villiger 산화반응이라 불리는 이반응은 케톤에 대해 아주 유용한 반응인데, 그것은 케톤을 카르복실 에스테르로 변환시키기 때문이다. 예를들어, 아세토페논을 퍼옥시산과 반응시키면 에스테르, 즉 아세트산 페닐로 전환된다.
퍼옥시산은 양성자가 첨가된 카르보닐 반응물을공격한다.
카르보닐 반응물이 산으로부터 양성자를 제거한다.
양성자가 옥소늄이온으로부터 제거된다.
이 중간체에서 퍼옥시산의 카르보닐 그룹에 양서자가 첨가되어 RCO2H부분을 이탈기로 만들어 준다.
페닐그룹이 전자쌍을 가지고 이웃 산소로 이동하며, 동시에 RCO2H가 이탈기로서 떠나간다.
양성자가 제거되어
에스테르 생성물이
얻어진다.
1. Gabriel 합성
2. Friedel-Crafts 아실화 반응
3. Friedel-Crafts 알킬화 반응
4. Diels-Alder반응
5. Dieckmann 축합반응
6. Wittig 반응
7. Micheal 반응
8. Williamson 에터 합성
9. Stricker 합성
10. Stock 합성
11. Minnich 반응
12. Kiliani-Fischer 합성
13. Reformatsky 반응
14. Hell-Volhard-Zelinski 반응
15. Kolbe 반응
16. Robinson 고리만듬 반응
17. Claisen 축합반응
18. Wolff-Kishner 반응
19. Koenigs-Knorr 반응
20. Baeyer-Villiger 산화반응
추천자료
 [과외]고등 화학2 4.탄화수소화합물.화학반응과에너지
[과외]고등 화학2 4.탄화수소화합물.화학반응과에너지 Grignard 반응
Grignard 반응 화학 실험 결과 레포트 8.비누화 반응
화학 실험 결과 레포트 8.비누화 반응 [광촉매] 광촉매의 개념과 분류, 반응원리, 조건, 장단점, 활용분야, 제조기술 및 용도, 정화...
[광촉매] 광촉매의 개념과 분류, 반응원리, 조건, 장단점, 활용분야, 제조기술 및 용도, 정화... 바이오연료 반응기 설계
바이오연료 반응기 설계 술폰화 반응
술폰화 반응 카니자로 자동 산화 &#8211; 환원 반응
카니자로 자동 산화 &#8211; 환원 반응 비누화 반응(예비)
비누화 반응(예비) 구운몽에 있어 음악의 서사적기능, 음악적 공간의 역동성, 음악에 대한 정서의 생리적반응, ...
구운몽에 있어 음악의 서사적기능, 음악적 공간의 역동성, 음악에 대한 정서의 생리적반응, ... [음악감상][음악감상의 지도단계][음악감상의 지도방법]음악감상의 가치, 음악감상의 종류, ...
[음악감상][음악감상의 지도단계][음악감상의 지도방법]음악감상의 가치, 음악감상의 종류, ... [건물][건축물]건물(건축물)의 유지관리, 건물(건축물)의 소화설비, 건물(건축물)의 마감재, ...
[건물][건축물]건물(건축물)의 유지관리, 건물(건축물)의 소화설비, 건물(건축물)의 마감재, ... (예비+결과) 산과 염기의 분석 - 산과 염기의 중화 반응을 이용해서 산이나 염기의 농도를 알...
(예비+결과) 산과 염기의 분석 - 산과 염기의 중화 반응을 이용해서 산이나 염기의 농도를 알... [실험보고서 The experimental report] <산화 - 환원 적정 : 과망간산법> : 과망간산 칼륨과 ...
[실험보고서 The experimental report] <산화 - 환원 적정 : 과망간산법> : 과망간산 칼륨과 ... 지질 검정 : 생체 주요 구성성분인 지질의 특성과 기능을 이해하고 지질과 특이적으로 반응하...
지질 검정 : 생체 주요 구성성분인 지질의 특성과 기능을 이해하고 지질과 특이적으로 반응하...





























소개글