목차
1. 고립 원자 내의 전자 에너지 준위
2. 결정 내의 전자 에너지 준위
3. 에너지대와 에너지대의 겹침
4. 전도체, 반도체, 절연체.
5. 참고.
2. 결정 내의 전자 에너지 준위
3. 에너지대와 에너지대의 겹침
4. 전도체, 반도체, 절연체.
5. 참고.
본문내용
서로 충만히 퍼져 중복되지만 그 이상은 퍼지지 않는다.
- (3d)와 (4s) 대는 중복되고 (4s)에는 반만 전자가 채워져 있으므로 대단히 우수한 도체가 된다.
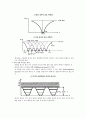
<금속의 에너지 밴드. (a:Na , b:Mg , c:Al)>
② 반도체 (Semiconductor)
- Si의 전자의 배치 (1s)2, (2s)2, (2p)6, (3s)2, (3p)2
- Si 원자를 서로 접근 시키면 (3p), (3s) 준위가 점점 벌어져 에너지대가 된다. 이때 (3p)의 한개 원자 당 6개상태중 2개 상태가 (3p)대 아래쪽으로 분포 되어 (3s)2과 공명 하면서 접근 한다.
-(3p)와 (3s)와의 교점에서 급격히 아래쪽의 에너지대에 혼합궤도를 만들게 된다.
- 따라서 이 궤도에는 전자로 충만 하게 된다.
- Si의 금지대는 1.12[eV]이므로 상온 부근에서 충만대로부터 전도대로 어느 정도의 전 자가 올라 갈 수 있어 전지 전도 현상이 나타나게 된다.
③절연체(Insulator)
- (예)이온 결합으로 되어 있는 KCl
- Cl의 전자 배치 (1s)2, (2s)2, (2p)6, (3s)2, (3p)5
최 외각(3p)준위에 폐각 (3p)6을 만들려면 1개의 전자 부족
-K의 전자 배치 (1s)2, (2s)2, (2p)6, (3s)2, (3p)6, (4s)1
(4s)준위에 가전자 1개
- 따라서 KCl은 K의 (4s)준위의 전자 1개를 Cl의 (3p)로 옮겨 Cl원자의 (3p)준위는 폐각 (3p)6을 만들게 된다.
- KCl의 절연 기구.
- N개의 Cl원자와 N개의 K언자로 된 KCl결정
- 이들 각각의 상태 준위의 수
(3s)상태에 2N*2개의 준위
(3p)상태에 6N*2, (4s)상태에 2N*2개의 준위가 있으나 KCl인 경우는 비어 있다.
- K의 (4s)상태의 전자 Nr는 Cl의 (3p)상태의 전자 5개에 합하여져 결국 (3p)준위에 는 (N+5N)*2개의 전자를 갖게 되고 K의 (4s)준위는 비어 있게 된다.
- KCl의 금지대는 약 10[eV]정도인데 이정도의 에너지를 외부에서 공급하기는 어려우 므로 절연체로 존재하게 되는 것이다.
<금속과 반도체, 절연체의 에너지 밴드 구조 비교>
5. 참고.
-http://user.dankook.ac.kr/~imlct/curri/MSE/MSE-1.ppt
- (3d)와 (4s) 대는 중복되고 (4s)에는 반만 전자가 채워져 있으므로 대단히 우수한 도체가 된다.
<금속의 에너지 밴드. (a:Na , b:Mg , c:Al)>
② 반도체 (Semiconductor)
- Si의 전자의 배치 (1s)2, (2s)2, (2p)6, (3s)2, (3p)2
- Si 원자를 서로 접근 시키면 (3p), (3s) 준위가 점점 벌어져 에너지대가 된다. 이때 (3p)의 한개 원자 당 6개상태중 2개 상태가 (3p)대 아래쪽으로 분포 되어 (3s)2과 공명 하면서 접근 한다.
-(3p)와 (3s)와의 교점에서 급격히 아래쪽의 에너지대에 혼합궤도를 만들게 된다.
- 따라서 이 궤도에는 전자로 충만 하게 된다.
- Si의 금지대는 1.12[eV]이므로 상온 부근에서 충만대로부터 전도대로 어느 정도의 전 자가 올라 갈 수 있어 전지 전도 현상이 나타나게 된다.
③절연체(Insulator)
- (예)이온 결합으로 되어 있는 KCl
- Cl의 전자 배치 (1s)2, (2s)2, (2p)6, (3s)2, (3p)5
최 외각(3p)준위에 폐각 (3p)6을 만들려면 1개의 전자 부족
-K의 전자 배치 (1s)2, (2s)2, (2p)6, (3s)2, (3p)6, (4s)1
(4s)준위에 가전자 1개
- 따라서 KCl은 K의 (4s)준위의 전자 1개를 Cl의 (3p)로 옮겨 Cl원자의 (3p)준위는 폐각 (3p)6을 만들게 된다.
- KCl의 절연 기구.
- N개의 Cl원자와 N개의 K언자로 된 KCl결정
- 이들 각각의 상태 준위의 수
(3s)상태에 2N*2개의 준위
(3p)상태에 6N*2, (4s)상태에 2N*2개의 준위가 있으나 KCl인 경우는 비어 있다.
- K의 (4s)상태의 전자 Nr는 Cl의 (3p)상태의 전자 5개에 합하여져 결국 (3p)준위에 는 (N+5N)*2개의 전자를 갖게 되고 K의 (4s)준위는 비어 있게 된다.
- KCl의 금지대는 약 10[eV]정도인데 이정도의 에너지를 외부에서 공급하기는 어려우 므로 절연체로 존재하게 되는 것이다.
<금속과 반도체, 절연체의 에너지 밴드 구조 비교>
5. 참고.
-http://user.dankook.ac.kr/~imlct/curri/MSE/MSE-1.ppt
키워드
추천자료
 프로이드와 에릭슨의 심리발달이론
프로이드와 에릭슨의 심리발달이론 융의 분석심리학적 성격이론
융의 분석심리학적 성격이론 통합교육과정의 이론적 배경과 교육계획안
통합교육과정의 이론적 배경과 교육계획안 리더십 이론에 관한 정리
리더십 이론에 관한 정리 [분석/조사] 결정장 이론
[분석/조사] 결정장 이론 사회체계 이론이 사회복지실천과의 연관성
사회체계 이론이 사회복지실천과의 연관성 간호의 정의와 간호이론의 기능 및 네가지 개념 간호역할 확대
간호의 정의와 간호이론의 기능 및 네가지 개념 간호역할 확대 집단상담의 성격 이론 계획 실제 설명
집단상담의 성격 이론 계획 실제 설명 프로이트와 에릭슨의 이론의 비교
프로이트와 에릭슨의 이론의 비교 상담의 주요이론(정신분석, 인본주의, 행동, 인지, 현실치료, 절충적상담)과 사회복지실천과...
상담의 주요이론(정신분석, 인본주의, 행동, 인지, 현실치료, 절충적상담)과 사회복지실천과... 보육과정 이론의 종류
보육과정 이론의 종류 화공기초 이론 및 실험 평형상수결정 예비레포트
화공기초 이론 및 실험 평형상수결정 예비레포트 [간호이론 A형] 매슬로의 욕구위계론과 관련해 작성. 1) 주변의 만성질환자 1인을 선정하여 ...
[간호이론 A형] 매슬로의 욕구위계론과 관련해 작성. 1) 주변의 만성질환자 1인을 선정하여 ... 정신분석 이론의 평가와 적용에 대하여 서술해 봅시다
정신분석 이론의 평가와 적용에 대하여 서술해 봅시다


























소개글