목차
About pH
Relation of pH, pKa
Introduce pH meter
The use of pH meter
Purpose
Principle of experiment
Equipment & reagent
Procedure
Guessing Result & analysis
Thinking problem
Reference
Relation of pH, pKa
Introduce pH meter
The use of pH meter
Purpose
Principle of experiment
Equipment & reagent
Procedure
Guessing Result & analysis
Thinking problem
Reference
본문내용
Relation of pH, pKa
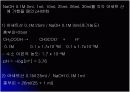
Ex) HA + H2O ↔ H3O+ + A-
이 때 H2O 는 용매 분자로서 농도가 일정하다고 볼 수 있으므로 …
Ka = [H3O+] [A-]
[HA]
∴ pKa = -log[Ka]
pKa 를 쓰는 이유
Ans.) Ka(acid ionization constant) 산이온화상수는 일반적으로 값이 워낙 작기 때문에 pKa 값을 도입하게 되었다.
Ex) 약산의 경우 Ka= 1.0 x 10-12
이를.. pKa 값으로 바꾸면 12가 된다. 일반적으로 산의 Ka값이 크면 클수록 이온화가잘된다라고 말한다. 그러므로 pKa값이 작으면 강산이라고 말한다.
Ex) HA + H2O ↔ H3O+ + A-
이 때 H2O 는 용매 분자로서 농도가 일정하다고 볼 수 있으므로 …
Ka = [H3O+] [A-]
[HA]
∴ pKa = -log[Ka]
pKa 를 쓰는 이유
Ans.) Ka(acid ionization constant) 산이온화상수는 일반적으로 값이 워낙 작기 때문에 pKa 값을 도입하게 되었다.
Ex) 약산의 경우 Ka= 1.0 x 10-12
이를.. pKa 값으로 바꾸면 12가 된다. 일반적으로 산의 Ka값이 크면 클수록 이온화가잘된다라고 말한다. 그러므로 pKa값이 작으면 강산이라고 말한다.