본문내용
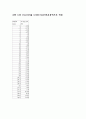
6
4.32
11.8
5.09
12
5.37
12.2
5.58
12.4
5.76
12.6
5.89
12.8
5.98
13.8
6.3
14.8
6.53
15.8
6.77
16.8
6.9
17.8
7.06
18.8
7.2
19.8
7.38
20.8
7.58
21.8
7.83
22.8
8.61
23
8.83
23.2
9.23
23.4
9.53
23.6
9.81
23.8
10.03
24
10.18
24.2
10.3
24.4
10.36
24.6
10.45
24.8
10.52
25.8
10.79
26.8
10.96
27.8
11.1
*저장용액에 있는 H3PO4의 농도 계산
NV=N\'V\'
N; NaOH의 농도 (0.100N)
V; 변곡점에서의 NaOH의 부피 (11.60)
N\'; H3PO4 농도 (x)
V\'; 취한 H3PO4의 부피 (25.00)
0.100N×11.60ml= x×25.00ml
x=0.0464
*첫 변곡점에서의 부피반을 취한 지점의 PH
부피;5.8ml PH;4.30
*H3PO4의 제1이온화상수 Ka1 계산
Ka1= (Cs;전체염의 농도, Ca; 전체 약산의 농도)
pH=-log〔H+〕=4.30
〔H+〕=10-4.30=5.019×10-5
Cs; 0.100N×5.80ml=x×215ml
x=2.70×10-3
Ca; 0.0464N
∴Ka1=
=8.150×10-5
pKa1=-logKa1=4.09
*변곡점 첫 번째점과 두 번째점의 중간부피와 pH
부피; 16.7ml pH; 6.90
Ka2=〔H+〕Cs /Ca
∴Ka2=〔H+〕, pKa2=pH
pKa2=6.90, -logKa2=6.90 ∴Ka2= 1.25×10-7
*실험치와 문헌치의 비교
실험치
문헌치(298K)
Ka1
8.150×10-5
7.50×10-3
pKa1
4.09
2.12
Ka2
1.25×10-7
6.20×10-3
pKa2
6.90
7.21
6.토의
이번실험은 pH meter를 이용하여 산염기 적정 과정의 pH 변화를 통해 적정곡선의 성질을 자세히 알아보고 약산의 이온화 상수를 구하는 것이다.
산이란 양성자(H+)를 내는 물질이며, 염기란 양성자를 받아들이는 물질이다. 예로 아세트산의 이온화 과정을 보면,
CH3COOH+H2O → CH3COOH+H2O
산1 염기2 염기2 산2
위의 반응에서 CH3COOH는 H+를 H2O에 주었으므로 산이 되고, H2O는 H+를 받았으므로 염기가 된다. 또, CH3COOH-는 H3O+에서 H+을 받았으므로 염기가 되고, H3O+은 H+를 주었으므로 산이 된다. 산,염기 개념은 한 쌍의 산과 한 쌍의 염기 사이의 반응으로 표현된다.
산1인 CH3COOH는 H+를 내어주어 염기1인 CH3COOH-으로 되고, 또 염기2인 H2O는 H+을 받아 산2인 H3O+으로 되는데, 이와 같이 H+의 이동에 의하여 산과 염기로 되는 한 쌍의 물질을 짝산 작염기라 한다. 즉, 산 CH3COOH의 짝염기는 CH3COOH-이고 염기 H2O의 짝산은 H3O+이다.
평형상수 K는 산의 세기나 염의 세기를 나타내는데 쓰인다. 강한 염기로 약산을 적정하면 양성자와 수산이온이 반응하여 물이 생기고 동시에 염이 만들어진다. 염기의 첨가로 용액 내의 염과 이온화 되지 않은 약산의 조성이 계속 달라진다. 따라서 용액의 수소이온 농도도 달라지게 된다.
용액 내의 농도 변화는 네 개의 평형방정식으로 나타낼 수 있다.
평형상태로 부터,
HA=H++A-
Ka=〔H+〕〔A-〕/〔HA〕 (1)
H2O=H++OH- (2)
전기적으로 중성이여야 하므로
〔H+〕+〔M+〕=〔H〕+Cs=〔A-〕+〔OH-〕 (3)
질량이 보존되므로,
Ca+Cs=〔HA〕+〔A-〕 (4)
Ka와 Kw는 각각 산과 물의 평형상수이고, Ca와 Cs는 각각 산과 염기의 전체농도를 나타낸다.
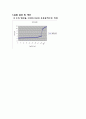
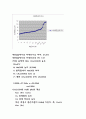
실험결과를 보면 pH 적정곡선은 당량점 부근에서 pH가 급격하게 변화하며 그 외에는 pH 변화가 적게 나타난다. 당량점 전에는 〔H+〕가 용액 속에 다량 존재하며, 당량점에서는 〔H+〕=〔OH-〕이며 당량점 후에는 〔OH-〕가 용액 속에 다량 존재하게 된다.
인산의 경우에는 그래프에 변곡점이 세 개 나타나는데 이것은 이온화의 영향이다.
<이온화반응>
HCl→H++Cl-
CH3COOH→H++CH3COOH-
H3PO4→H++H2PO4- (1)
H2PO4-→H++HPO42- (2)
HPO42-→H++PO43- (3)
이와 같이 염산과 아세트산의 경우 이온화가 한번 일어나 그래프에서 변곡점이 한번 나타나고, 인산의 경우 세 번의 이온화로 변곡점이 세 개 나타나는 것이다 그러나 인산의 이온화 반응에서는 (1)번 반응에 비해 (2)번 반응이 힘들게 일어나며 (2)번 반응에 비해 (3)번 반응이 더 일어나기 힘들다 H+가 잘 떨어지지 않는 다는 것이다. 그래서 세 개의 변곡점이 다 나타나기가 쉽지 않다.
약한산의 경우에는 (CH3COOH)산이 묽어질수록 이온화 백분율이 증가하여(단위 부피당 입자의 수 감소), 반작용으로 더 많은 입자를 생성하기 위해 이온화된다. 이번실험과 같은 산과 염기의 반응에서는 이온화에 의해 산과 이온화한다. 이번실험과 같은 산과 염기의 반응에서는 이온화도에 의해 산과 염기의 상대적인 세기를 알 수 있다. 이온화도는 Ka로 표시하며, 이 Ka를 이온호 k상수라 한다.
이온화 상수 값이 틀수록 이온화가 잘 되는 것이며 센산, 센염기를 나타낸다. 아세트산이 물 속에서 이온화 하면 각 성분의 농도가 일정하게 유지되는데 이때 산의 이온화 상수 Ka는 평형상수와 같이 온도에 따라서만 변한다.
인산의 경우 Ka1이 Ka2보다 더 정확하다고 할 수 있는데, 왜냐하면 이산의 이온화 과정에서 반응속도를 결정하는 단계가 첫 번째 반응이가 때문이다.
실험값과 문헌값과는 많은 차이가 있었는데 이것은 pH meter에 오차가 있어서 이다. pH meter에서 매우 산성인 용액 중에서 측정된 pH가 실제 pH보다 더 높을 수 있는데 이것은 진한 산용액중에서 물의 활동도가 감소되기 때문이라고 할 수 있다.
7.참고문헌
1)정량분석화학(1) 이동선 1988 대웅출판 P143-144
2)물리화학 R.A.Alberty 길중당 P275-276
3)정량분석화학 이충영외7명 1995 P393-394
4.32
11.8
5.09
12
5.37
12.2
5.58
12.4
5.76
12.6
5.89
12.8
5.98
13.8
6.3
14.8
6.53
15.8
6.77
16.8
6.9
17.8
7.06
18.8
7.2
19.8
7.38
20.8
7.58
21.8
7.83
22.8
8.61
23
8.83
23.2
9.23
23.4
9.53
23.6
9.81
23.8
10.03
24
10.18
24.2
10.3
24.4
10.36
24.6
10.45
24.8
10.52
25.8
10.79
26.8
10.96
27.8
11.1
*저장용액에 있는 H3PO4의 농도 계산
NV=N\'V\'
N; NaOH의 농도 (0.100N)
V; 변곡점에서의 NaOH의 부피 (11.60)
N\'; H3PO4 농도 (x)
V\'; 취한 H3PO4의 부피 (25.00)
0.100N×11.60ml= x×25.00ml
x=0.0464
*첫 변곡점에서의 부피반을 취한 지점의 PH
부피;5.8ml PH;4.30
*H3PO4의 제1이온화상수 Ka1 계산
Ka1= (Cs;전체염의 농도, Ca; 전체 약산의 농도)
pH=-log〔H+〕=4.30
〔H+〕=10-4.30=5.019×10-5
Cs; 0.100N×5.80ml=x×215ml
x=2.70×10-3
Ca; 0.0464N
∴Ka1=
=8.150×10-5
pKa1=-logKa1=4.09
*변곡점 첫 번째점과 두 번째점의 중간부피와 pH
부피; 16.7ml pH; 6.90
Ka2=〔H+〕Cs /Ca
∴Ka2=〔H+〕, pKa2=pH
pKa2=6.90, -logKa2=6.90 ∴Ka2= 1.25×10-7
*실험치와 문헌치의 비교
실험치
문헌치(298K)
Ka1
8.150×10-5
7.50×10-3
pKa1
4.09
2.12
Ka2
1.25×10-7
6.20×10-3
pKa2
6.90
7.21
6.토의
이번실험은 pH meter를 이용하여 산염기 적정 과정의 pH 변화를 통해 적정곡선의 성질을 자세히 알아보고 약산의 이온화 상수를 구하는 것이다.
산이란 양성자(H+)를 내는 물질이며, 염기란 양성자를 받아들이는 물질이다. 예로 아세트산의 이온화 과정을 보면,
CH3COOH+H2O → CH3COOH+H2O
산1 염기2 염기2 산2
위의 반응에서 CH3COOH는 H+를 H2O에 주었으므로 산이 되고, H2O는 H+를 받았으므로 염기가 된다. 또, CH3COOH-는 H3O+에서 H+을 받았으므로 염기가 되고, H3O+은 H+를 주었으므로 산이 된다. 산,염기 개념은 한 쌍의 산과 한 쌍의 염기 사이의 반응으로 표현된다.
산1인 CH3COOH는 H+를 내어주어 염기1인 CH3COOH-으로 되고, 또 염기2인 H2O는 H+을 받아 산2인 H3O+으로 되는데, 이와 같이 H+의 이동에 의하여 산과 염기로 되는 한 쌍의 물질을 짝산 작염기라 한다. 즉, 산 CH3COOH의 짝염기는 CH3COOH-이고 염기 H2O의 짝산은 H3O+이다.
평형상수 K는 산의 세기나 염의 세기를 나타내는데 쓰인다. 강한 염기로 약산을 적정하면 양성자와 수산이온이 반응하여 물이 생기고 동시에 염이 만들어진다. 염기의 첨가로 용액 내의 염과 이온화 되지 않은 약산의 조성이 계속 달라진다. 따라서 용액의 수소이온 농도도 달라지게 된다.
용액 내의 농도 변화는 네 개의 평형방정식으로 나타낼 수 있다.
평형상태로 부터,
HA=H++A-
Ka=〔H+〕〔A-〕/〔HA〕 (1)
H2O=H++OH- (2)
전기적으로 중성이여야 하므로
〔H+〕+〔M+〕=〔H〕+Cs=〔A-〕+〔OH-〕 (3)
질량이 보존되므로,
Ca+Cs=〔HA〕+〔A-〕 (4)
Ka와 Kw는 각각 산과 물의 평형상수이고, Ca와 Cs는 각각 산과 염기의 전체농도를 나타낸다.
실험결과를 보면 pH 적정곡선은 당량점 부근에서 pH가 급격하게 변화하며 그 외에는 pH 변화가 적게 나타난다. 당량점 전에는 〔H+〕가 용액 속에 다량 존재하며, 당량점에서는 〔H+〕=〔OH-〕이며 당량점 후에는 〔OH-〕가 용액 속에 다량 존재하게 된다.
인산의 경우에는 그래프에 변곡점이 세 개 나타나는데 이것은 이온화의 영향이다.
<이온화반응>
HCl→H++Cl-
CH3COOH→H++CH3COOH-
H3PO4→H++H2PO4- (1)
H2PO4-→H++HPO42- (2)
HPO42-→H++PO43- (3)
이와 같이 염산과 아세트산의 경우 이온화가 한번 일어나 그래프에서 변곡점이 한번 나타나고, 인산의 경우 세 번의 이온화로 변곡점이 세 개 나타나는 것이다 그러나 인산의 이온화 반응에서는 (1)번 반응에 비해 (2)번 반응이 힘들게 일어나며 (2)번 반응에 비해 (3)번 반응이 더 일어나기 힘들다 H+가 잘 떨어지지 않는 다는 것이다. 그래서 세 개의 변곡점이 다 나타나기가 쉽지 않다.
약한산의 경우에는 (CH3COOH)산이 묽어질수록 이온화 백분율이 증가하여(단위 부피당 입자의 수 감소), 반작용으로 더 많은 입자를 생성하기 위해 이온화된다. 이번실험과 같은 산과 염기의 반응에서는 이온화에 의해 산과 이온화한다. 이번실험과 같은 산과 염기의 반응에서는 이온화도에 의해 산과 염기의 상대적인 세기를 알 수 있다. 이온화도는 Ka로 표시하며, 이 Ka를 이온호 k상수라 한다.
이온화 상수 값이 틀수록 이온화가 잘 되는 것이며 센산, 센염기를 나타낸다. 아세트산이 물 속에서 이온화 하면 각 성분의 농도가 일정하게 유지되는데 이때 산의 이온화 상수 Ka는 평형상수와 같이 온도에 따라서만 변한다.
인산의 경우 Ka1이 Ka2보다 더 정확하다고 할 수 있는데, 왜냐하면 이산의 이온화 과정에서 반응속도를 결정하는 단계가 첫 번째 반응이가 때문이다.
실험값과 문헌값과는 많은 차이가 있었는데 이것은 pH meter에 오차가 있어서 이다. pH meter에서 매우 산성인 용액 중에서 측정된 pH가 실제 pH보다 더 높을 수 있는데 이것은 진한 산용액중에서 물의 활동도가 감소되기 때문이라고 할 수 있다.
7.참고문헌
1)정량분석화학(1) 이동선 1988 대웅출판 P143-144
2)물리화학 R.A.Alberty 길중당 P275-276
3)정량분석화학 이충영외7명 1995 P393-394
































소개글