목차
5. 실험결과
6. 토의
7. 결론
8. 참고문헌
6. 토의
7. 결론
8. 참고문헌
본문내용
중간부피 = 32.00ml pH = 6.85
Ka2 = [H+] × (Cs / Ca)
Ka2 = [H+] (pKa2 = pH)
-logKa2 = 6.85
Ka2 = 1.41 ×10-7
6. 토의
이번 실험은 강 1염기산과 강 2염기산 및 약 1염기산과 약 2염기산의 적정곡선의 성질을 자세히 알아보고 약산의 이온화 상수를 구하는 것이다.
약산을 강한 염기로 적정하는 과정에서 약산의 염이 만들어진다. 이것은 염기가 일단 첨가되면 그 용액 안에서 염과 이온화되지 않은 산의 비가 계속하여 변함을 뜻한다. 이러한 용액을 완충용액이라 하며 적정의 초기와 당량점에 아주 가까워졌을 때를 제외하고는 적정하는 동안 pH가 천천히 변한다.
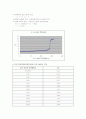
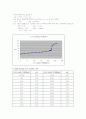
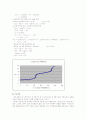
첫 번째 실험은 강산인 HCl과 강염기 NaOH의 반응이고, 두 번째 실험은 약산인 CH3COOH와 강염기 NaOH의 반응, 마지막으로 삼양성자 약산 H3PO4와 강염기 NaOH의 반응이다.
먼저 센 산과 센 염기의 적정의 그래프는 당량점 부근까지는 염기의 pH가 그다지 큰 변화를 일으키지 않는다. 당량점 직전에 있는 용액에 극히 소량의 염기(염기의 중화에서는 산)를 첨가하면 급격히 pH의 변화가 일어난다는 점을 주의해야 한다. 실제 실험에서 28.00ml NaOH가 들어가 반응하였을 때는 서서히 pH변화가 일어났었지만 29.00ml의 NaOH가 반응하였을 때는 28.00ml의 NaOH에서 1.00ml의 염기를 더 첨가하였을 뿐임에도 불구하고 pH가 4.03에서 10.78로 급격하게 변화하는 것을 확인할 수 있었다. 이러한 적정곡선의 형태로부터 적정에 의해 매우 정확하게 당량점을 구할 수 있다. 두 번째 실험으로 약한 산-센 염기의 경우인 CH3COOH의 경우를 살펴보면 앞의 실험인 HCl과 같은 강산의 경우와는 달리 서서히 pH의 변화를 보였다. 이 그래프에서는 완충영역인 pH4에서 pH6에 주목하여야 한다. 마지막 실험인 삼양성자 약한 산 H3PO4와 NaOH의 반응을 살펴보면
H3PO4 → H+ + H2PO4-
H2PO4- → H+ + HPO42-
HPO42- → PO43-
로 세 번의 이온화가 일어난다. 이 때문에 염기를 이용하여 적정하였을 경우 3번의 변곡점이 나오게 되는데, 이번 실험에서는 2번의 변곡점만이 존재한다. 그 이유는 약산을 강염기로 적정하였기 때문인데, 약한 산의 경우는 산이 묽어질수록 이온화 백분율이 증가하여 즉, 단위 부피당 입자수가 감소하여 반작용으로 인해 더 많은 입자를 생성하기 위해 이온화된다. 이번 실험과 같은 산과 염기의 반응에서는 이온화도에 의해 산과 염기의 상대적인 세기를 알 수 있다. 이온화도는 Ka로 표시하며, 이 Ka를 이온화 상수라고 한다. 이온화 상수 값이 클수록 이온화가 잘되며 센 산-센 염기라고 할 수 있다.
7. 결론
CH3COOH의 Ka값은 2.63 × 10-5이고, H3PO4의 Ka1값은 2.77 × 10-4, Ka2값은 1.41 × 10-7이다.
8. 참고문헌
① 물리화학. 길중당. R.A.Alberty
② 정량분석화학. 이충영 외 7명. 동화기술. 1995.
Ka2 = [H+] × (Cs / Ca)
Ka2 = [H+] (pKa2 = pH)
-logKa2 = 6.85
Ka2 = 1.41 ×10-7
6. 토의
이번 실험은 강 1염기산과 강 2염기산 및 약 1염기산과 약 2염기산의 적정곡선의 성질을 자세히 알아보고 약산의 이온화 상수를 구하는 것이다.
약산을 강한 염기로 적정하는 과정에서 약산의 염이 만들어진다. 이것은 염기가 일단 첨가되면 그 용액 안에서 염과 이온화되지 않은 산의 비가 계속하여 변함을 뜻한다. 이러한 용액을 완충용액이라 하며 적정의 초기와 당량점에 아주 가까워졌을 때를 제외하고는 적정하는 동안 pH가 천천히 변한다.
첫 번째 실험은 강산인 HCl과 강염기 NaOH의 반응이고, 두 번째 실험은 약산인 CH3COOH와 강염기 NaOH의 반응, 마지막으로 삼양성자 약산 H3PO4와 강염기 NaOH의 반응이다.
먼저 센 산과 센 염기의 적정의 그래프는 당량점 부근까지는 염기의 pH가 그다지 큰 변화를 일으키지 않는다. 당량점 직전에 있는 용액에 극히 소량의 염기(염기의 중화에서는 산)를 첨가하면 급격히 pH의 변화가 일어난다는 점을 주의해야 한다. 실제 실험에서 28.00ml NaOH가 들어가 반응하였을 때는 서서히 pH변화가 일어났었지만 29.00ml의 NaOH가 반응하였을 때는 28.00ml의 NaOH에서 1.00ml의 염기를 더 첨가하였을 뿐임에도 불구하고 pH가 4.03에서 10.78로 급격하게 변화하는 것을 확인할 수 있었다. 이러한 적정곡선의 형태로부터 적정에 의해 매우 정확하게 당량점을 구할 수 있다. 두 번째 실험으로 약한 산-센 염기의 경우인 CH3COOH의 경우를 살펴보면 앞의 실험인 HCl과 같은 강산의 경우와는 달리 서서히 pH의 변화를 보였다. 이 그래프에서는 완충영역인 pH4에서 pH6에 주목하여야 한다. 마지막 실험인 삼양성자 약한 산 H3PO4와 NaOH의 반응을 살펴보면
H3PO4 → H+ + H2PO4-
H2PO4- → H+ + HPO42-
HPO42- → PO43-
로 세 번의 이온화가 일어난다. 이 때문에 염기를 이용하여 적정하였을 경우 3번의 변곡점이 나오게 되는데, 이번 실험에서는 2번의 변곡점만이 존재한다. 그 이유는 약산을 강염기로 적정하였기 때문인데, 약한 산의 경우는 산이 묽어질수록 이온화 백분율이 증가하여 즉, 단위 부피당 입자수가 감소하여 반작용으로 인해 더 많은 입자를 생성하기 위해 이온화된다. 이번 실험과 같은 산과 염기의 반응에서는 이온화도에 의해 산과 염기의 상대적인 세기를 알 수 있다. 이온화도는 Ka로 표시하며, 이 Ka를 이온화 상수라고 한다. 이온화 상수 값이 클수록 이온화가 잘되며 센 산-센 염기라고 할 수 있다.
7. 결론
CH3COOH의 Ka값은 2.63 × 10-5이고, H3PO4의 Ka1값은 2.77 × 10-4, Ka2값은 1.41 × 10-7이다.
8. 참고문헌
① 물리화학. 길중당. R.A.Alberty
② 정량분석화학. 이충영 외 7명. 동화기술. 1995.
추천자료
 식초중 아세트산의 정량
식초중 아세트산의 정량 젖산 및 암모니아 정량
젖산 및 암모니아 정량 0.1N-I2 표준용액의 제조 및 Formalin의 정량
0.1N-I2 표준용액의 제조 및 Formalin의 정량 0.1N-질산은(AgNO3) 표준용액의 조제 및 염화물의 정량
0.1N-질산은(AgNO3) 표준용액의 조제 및 염화물의 정량 COD크롬법(화학적산소요구량)
COD크롬법(화학적산소요구량) 요오드황산구리(화학) 예비보고서
요오드황산구리(화학) 예비보고서 과산화수소의 농도측정
과산화수소의 농도측정 0.1N-I2 표준용액 조제 및 표정
0.1N-I2 표준용액 조제 및 표정 표백분(CaOCl2)중의 유효 염소의 정량
표백분(CaOCl2)중의 유효 염소의 정량 식초중 아세트산의 정량
식초중 아세트산의 정량 무기화학 ; 요오드의 제조
무기화학 ; 요오드의 제조 [위생학 실험] 황화수소 시험 - 이 시험법은 화학반응 등에 따라 굴뚝 등에서 배출되는 배출...
[위생학 실험] 황화수소 시험 - 이 시험법은 화학반응 등에 따라 굴뚝 등에서 배출되는 배출... 예비렙 EDTA Titration of Ca2 and 〖Mg〗^(2+) in Natural Water
예비렙 EDTA Titration of Ca2 and 〖Mg〗^(2+) in Natural Water 식품화학실험A+) 식품중의 식염 정량
식품화학실험A+) 식품중의 식염 정량

























소개글