목차
Ⅰ. 서 론
1.1 연구의 목적 및 배경
Ⅱ. 본 론
1. 휴믹산
2. 포름알데히드
3. TiO2 광촉매 반응
3.1 자외선 UV-A
3.2 TiO2 광촉매
3.3 광촉매 종류와 특징
Ⅲ. 실험 재료 및 방법
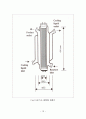
1 실험재료
1.1 TiO2 광촉매
1.2 휴믹산
1.3 포름알데히드
1.4 실험조건
1.1 연구의 목적 및 배경
Ⅱ. 본 론
1. 휴믹산
2. 포름알데히드
3. TiO2 광촉매 반응
3.1 자외선 UV-A
3.2 TiO2 광촉매
3.3 광촉매 종류와 특징
Ⅲ. 실험 재료 및 방법
1 실험재료
1.1 TiO2 광촉매
1.2 휴믹산
1.3 포름알데히드
1.4 실험조건
본문내용
aOH를 이용하여 pH를 5로 맞추어 8시간 동안 반응시킨후 제거율을 분석하였다.
Ⅳ. 결과 및 고찰
1. 휴믹산
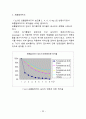
Fig.5은 휴믹산의 농도를 5, 10, 20, 30 mg/L로 변환시키면서 휴믹산의 제거율을 나타낸 결과이다.
휴믹산의 농도가 증가할수록 제거율이 감소되는 경향을 나타내고 있다.
이것은 유기물질이 일정수준 이상 농도에서 정공소비제(hole scavenger) 로 작용하여 전자와 정공의 재결합을 감소시킴으로서 반응효율을 증가시키지만 그 이상의 유기물 농도에서는 효과가 없고, 오히려 유기물 자체가 내부 필터로 작용하여 자외선을 강하게 흡수함으로서 작용하는 TiO2가 빛을 받아들이는 면적이 감소하여 전체 반응효율이 줄어드는 것으로 생각할 수 있다.
그러나 이러한 처리효율은 모델 실험 조건에서 짧은 시간(8시간)동안 처리한 결과이므로 처리시간을 보다 길게할 경우는 제거 효율이 증가할 것으로 판단된다.
Fig.5 휴믹산 농도의 변화에 따른 제거율
2. 포름알데히드
Fig.6은 포름알데히드의 농도를 2, 4, 8, 10 mg/L로 변환시키면서 포름알데히드의 제거율을 나타낸 결과이다.
포름알데히드의 농도가 증가할수록 제거율이 감소되는 경향을 나타내고 있다.
이것은 유기물질이 일정수준 이상 농도에서 정공소비제(hole scavenger) 로 작용하여 전자와 정공의 재결합을 감소시킴으로서 반응효율을 증가시키지만 그 이상의 유기물 농도에서는 효과가 없고, 오히려 유기물 자체가 내부 필터로 작용하여 자외선을 강하게 흡수함으로서 작용하는 TiO2가 빛을 받아들이는 면적이 감소하여 전체 반응효율이 줄어드는 것으로 생각할 수 있다.
Fig.6 포름알데히드 농도의 변화에 따른 제거율
3. 휴믹산과 포름알데히드의 혼합액
광촉매 반응을 휴믹산과 포름알데히드를 혼합액에 적용할 경우 농도에 따른 영향을 평가하 위하여 농도를 (휴믹10mg/L : 포름8mg/L, 휴믹
20mg/L : 포름4mg/L, 휴믹30mg/L : 포름2mg/L, 휴믹30mg/L : 포름4mg/L,
휴믹30mg/L : 포름8mg/L) 조정하여 8시간 실험을 수행하였으며 그결과는
Fig.7, Fig.8, Fig.9, Fig.10, Fig.11과 같다.
휴믹산과 포름알데히드의 혼합액의 농도가 증가할수록 제거율이 감소되는 경향을 나타내고 있다.
Table.5에서는 휴믹산과 포름알데히드를 각각 8시간 처리후 휴믹의 파장 254nm와 포름알데히드의 파장 550nm에서 각각 흡광도를 측정하여 효율을 나타낸 것이고, Table.6은 휴믹산과 포름알데히드의 혼합액을 8시간 처리후 휴믹의 파장254nm와 포름알데히드의 파장 550nm에서 각각
흡광도를 측정하여 효율을 나타낸 것이다.
이것은 유기물질이 일정수준 이상 농도에서 정공소비제(hole scavenger) 로 작용하여 전자와 정공의 재결합을 감소시킴으로서 반응효율을 증가시키지만 그 이상의 유기물 농도에서는 효과가 없고, 오히려 유기물 자체가 내부 필터로 작용하여 자외선을 강하게 흡수함으로서 작용하는 TiO2가 빛을 받아들이는 면적이 감소하여 전체 반응효율이 줄어드는 것으로 생각할 수 있다.
용액
8시간 처리후 제거율
Humic acid
254nm
5mg/L
10mg/L
20mg/L
30mg/L
98%
44%
38%
38%
Formaldehyde
550nm
2mg/L
4mg/L
8mg/L
10mg/L
100%
72%
81%
53%
Table.5 휴믹산과 포름알데히드 농도의 변화에 따른 효율
용액
8시간 처리후 제거율
H 10mg/L
F 8 mg/L
H 20mg/L
F 4 mg/L
H 30mg/L
F 2 mg/L
H 30mg/L
F 4 mg/L
H 30mg/L
H 8 mg/L
Humic acid
254nm
34%
10%
6%
21%
12%
Formaldehyde
550nm
61%
23%
97%
39%
16%
Table.6 휴믹산과 포름알데히드 혼합액 농도의 변화에 따른 효율
Fig.7 휴믹산 농도10mg/L와 포름알데히드 농도8mg/L의 혼합액
Fig.8 휴믹산 농도20mg/L와 포름알데히드 농도4mg/L의 혼합액
Fig.9 휴믹산 농도30mg/L와 포름알데히드 농도2mg/L의 혼합액
Fig.10 휴믹산 농도30mg/L와 포름알데히드 농도4mg/L의 혼합액
Fig.11 휴믹산 농도30mg/L와 포름알데히드 농도8mg/L의 혼합액
Ⅴ. 결 론
THM 생성의 전구물질인 휴믹산과 포름알데히드를 제거시키기 위하여 TiO2 광촉매 반응을 이용하여 자외선의 파장, pH, 휴믹산과 포름알데히드 혼합액의 초기농도, 유량등을 변화 시키면서 실험을 수행하여 얻어진 결
과는 다음과 같다.
1) 휴믹산의 농도는 낮을수록 제거율이 증가하는 경향을 나타냈다.
2) 휴믹산의 농도는 시간이 흐를수록 TiO2 광촉매 반응에 의해 제거율이 높게 나타났다.
3) 포름알데히드 농도는 낮을수록 제거율이 증가하는 경향을 나타냈다.
4) 포름알데히드 농도는 시간이 흐를수록 TiO2 광촉매 반응에 의해 제거 율이 높게 나타났다.
5) 포름알데히드 휴믹산과 포름알데히드 혼합액의 농도가 낮을 수록 제거 율은 증가하는 경향을 나타났다.
6) 시간이 흐를수록 휴믹산과 포름알데히드 혼합액이 TiO2 광촉매 반응에 의해 제거율이 높게 나타났다.
참고문헌
1. 석상일, 안복엽, 서태수, 이동석,“TiO2 광졸-겔 코팅 막에 의한 Huminc
acid의 광분해 - 화학적 산화법에 의한 부식산의 분해처리 기술에 관 한 연구 (Ⅱ) - 대한환경공학회지, Vol.22.No.4.pp.765~773.2000.
2. 이준재, 서정권, 홍지숙, 이정민, “광촉매 현탁액을 이용한 Humic acid 분해 효율 평가”, 대한 환경공학회지, pp.719~724.2004.
3. 정동석, 정상철. “화학기상증착에 의한 TiO2 광촉매 막의성”순천대
학교 산업대학원,2001.
4. 황인철 “TiO2 광촉매를 이용한 THM 전구물질의 제거에 관한 연구.2005.
5. 전희동, J,of KSEE Vol.16, No7, pp.809~818(1994.)
6. 강준원, 박훈수, 최광호. J. of KSee Vol.17, No3, pp.283~294(1995.)
Ⅳ. 결과 및 고찰
1. 휴믹산
Fig.5은 휴믹산의 농도를 5, 10, 20, 30 mg/L로 변환시키면서 휴믹산의 제거율을 나타낸 결과이다.
휴믹산의 농도가 증가할수록 제거율이 감소되는 경향을 나타내고 있다.
이것은 유기물질이 일정수준 이상 농도에서 정공소비제(hole scavenger) 로 작용하여 전자와 정공의 재결합을 감소시킴으로서 반응효율을 증가시키지만 그 이상의 유기물 농도에서는 효과가 없고, 오히려 유기물 자체가 내부 필터로 작용하여 자외선을 강하게 흡수함으로서 작용하는 TiO2가 빛을 받아들이는 면적이 감소하여 전체 반응효율이 줄어드는 것으로 생각할 수 있다.
그러나 이러한 처리효율은 모델 실험 조건에서 짧은 시간(8시간)동안 처리한 결과이므로 처리시간을 보다 길게할 경우는 제거 효율이 증가할 것으로 판단된다.
Fig.5 휴믹산 농도의 변화에 따른 제거율
2. 포름알데히드
Fig.6은 포름알데히드의 농도를 2, 4, 8, 10 mg/L로 변환시키면서 포름알데히드의 제거율을 나타낸 결과이다.
포름알데히드의 농도가 증가할수록 제거율이 감소되는 경향을 나타내고 있다.
이것은 유기물질이 일정수준 이상 농도에서 정공소비제(hole scavenger) 로 작용하여 전자와 정공의 재결합을 감소시킴으로서 반응효율을 증가시키지만 그 이상의 유기물 농도에서는 효과가 없고, 오히려 유기물 자체가 내부 필터로 작용하여 자외선을 강하게 흡수함으로서 작용하는 TiO2가 빛을 받아들이는 면적이 감소하여 전체 반응효율이 줄어드는 것으로 생각할 수 있다.
Fig.6 포름알데히드 농도의 변화에 따른 제거율
3. 휴믹산과 포름알데히드의 혼합액
광촉매 반응을 휴믹산과 포름알데히드를 혼합액에 적용할 경우 농도에 따른 영향을 평가하 위하여 농도를 (휴믹10mg/L : 포름8mg/L, 휴믹
20mg/L : 포름4mg/L, 휴믹30mg/L : 포름2mg/L, 휴믹30mg/L : 포름4mg/L,
휴믹30mg/L : 포름8mg/L) 조정하여 8시간 실험을 수행하였으며 그결과는
Fig.7, Fig.8, Fig.9, Fig.10, Fig.11과 같다.
휴믹산과 포름알데히드의 혼합액의 농도가 증가할수록 제거율이 감소되는 경향을 나타내고 있다.
Table.5에서는 휴믹산과 포름알데히드를 각각 8시간 처리후 휴믹의 파장 254nm와 포름알데히드의 파장 550nm에서 각각 흡광도를 측정하여 효율을 나타낸 것이고, Table.6은 휴믹산과 포름알데히드의 혼합액을 8시간 처리후 휴믹의 파장254nm와 포름알데히드의 파장 550nm에서 각각
흡광도를 측정하여 효율을 나타낸 것이다.
이것은 유기물질이 일정수준 이상 농도에서 정공소비제(hole scavenger) 로 작용하여 전자와 정공의 재결합을 감소시킴으로서 반응효율을 증가시키지만 그 이상의 유기물 농도에서는 효과가 없고, 오히려 유기물 자체가 내부 필터로 작용하여 자외선을 강하게 흡수함으로서 작용하는 TiO2가 빛을 받아들이는 면적이 감소하여 전체 반응효율이 줄어드는 것으로 생각할 수 있다.
용액
8시간 처리후 제거율
Humic acid
254nm
5mg/L
10mg/L
20mg/L
30mg/L
98%
44%
38%
38%
Formaldehyde
550nm
2mg/L
4mg/L
8mg/L
10mg/L
100%
72%
81%
53%
Table.5 휴믹산과 포름알데히드 농도의 변화에 따른 효율
용액
8시간 처리후 제거율
H 10mg/L
F 8 mg/L
H 20mg/L
F 4 mg/L
H 30mg/L
F 2 mg/L
H 30mg/L
F 4 mg/L
H 30mg/L
H 8 mg/L
Humic acid
254nm
34%
10%
6%
21%
12%
Formaldehyde
550nm
61%
23%
97%
39%
16%
Table.6 휴믹산과 포름알데히드 혼합액 농도의 변화에 따른 효율
Fig.7 휴믹산 농도10mg/L와 포름알데히드 농도8mg/L의 혼합액
Fig.8 휴믹산 농도20mg/L와 포름알데히드 농도4mg/L의 혼합액
Fig.9 휴믹산 농도30mg/L와 포름알데히드 농도2mg/L의 혼합액
Fig.10 휴믹산 농도30mg/L와 포름알데히드 농도4mg/L의 혼합액
Fig.11 휴믹산 농도30mg/L와 포름알데히드 농도8mg/L의 혼합액
Ⅴ. 결 론
THM 생성의 전구물질인 휴믹산과 포름알데히드를 제거시키기 위하여 TiO2 광촉매 반응을 이용하여 자외선의 파장, pH, 휴믹산과 포름알데히드 혼합액의 초기농도, 유량등을 변화 시키면서 실험을 수행하여 얻어진 결
과는 다음과 같다.
1) 휴믹산의 농도는 낮을수록 제거율이 증가하는 경향을 나타냈다.
2) 휴믹산의 농도는 시간이 흐를수록 TiO2 광촉매 반응에 의해 제거율이 높게 나타났다.
3) 포름알데히드 농도는 낮을수록 제거율이 증가하는 경향을 나타냈다.
4) 포름알데히드 농도는 시간이 흐를수록 TiO2 광촉매 반응에 의해 제거 율이 높게 나타났다.
5) 포름알데히드 휴믹산과 포름알데히드 혼합액의 농도가 낮을 수록 제거 율은 증가하는 경향을 나타났다.
6) 시간이 흐를수록 휴믹산과 포름알데히드 혼합액이 TiO2 광촉매 반응에 의해 제거율이 높게 나타났다.
참고문헌
1. 석상일, 안복엽, 서태수, 이동석,“TiO2 광졸-겔 코팅 막에 의한 Huminc
acid의 광분해 - 화학적 산화법에 의한 부식산의 분해처리 기술에 관 한 연구 (Ⅱ) - 대한환경공학회지, Vol.22.No.4.pp.765~773.2000.
2. 이준재, 서정권, 홍지숙, 이정민, “광촉매 현탁액을 이용한 Humic acid 분해 효율 평가”, 대한 환경공학회지, pp.719~724.2004.
3. 정동석, 정상철. “화학기상증착에 의한 TiO2 광촉매 막의성”순천대
학교 산업대학원,2001.
4. 황인철 “TiO2 광촉매를 이용한 THM 전구물질의 제거에 관한 연구.2005.
5. 전희동, J,of KSEE Vol.16, No7, pp.809~818(1994.)
6. 강준원, 박훈수, 최광호. J. of KSee Vol.17, No3, pp.283~294(1995.)














































소개글