목차
게요
원리
실험순서
실험결과
고찰
원리
실험순서
실험결과
고찰
본문내용
우에 적정곡선의 모양이 다른 이유는 무엇인가?
- HCl : 10.75
- CH3COOH : 9.57
- 강산인 HCl은 용해되자마자 이온화하여 모두 와 상태로 존재하고 NaOH 첨가시 바로 반응하여 종말점에서 NaCL이라는 중성염이 만들어진다. 하지만 CH3COOH는 약산이어서 용해되면 아주 일부가 인온화하고 원래물질과 화학 평형을 이루어 NaOH 첨가시 비교적 반응이 늦고 종말점에서 라는 염기성 염이 만들어지기 때문이다.
4) CH3COOH의 이온화상수(산해리상수)를 구하라.
=>
5. 실험 고찰
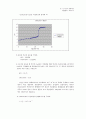
=> 이번 실험은 산-염기 중화적정 실험을 통하여 미지의 산의 농도를 구하였다. 염산 과 식초를 둘 다 20ml씩 떠와서 0.1N의 수산화나트륨으로 중화 적정을 하였다. 염산 은 19ml를 청가했을 때, 식초는 24.5ml를 첨가했을 때, 염산은 주황색에서 노란색으 로, 식초는 무색에서 붉은색으로 바뀌었다. 지시약의 색깔이 갑자기 변화는 지점을 종 말점이라고 생각하고 염산과 식초의 몰농도를 구했을 때, 염산은 0.095M, 식초는 0.1225M였다. 의 공식을 써서 각각 산의 농도를 구해 오차 백분율을 구 하면 각각 5%, 22.5%로 오차가 났다. 이번 오차의 원인은 색깔 변화와 pH변화에 있 는데, 색이 변하는 것은 순간이기 때문에 불연속적인 수산화나트륨의 투입량을 가지고 서 투입된 NaOH의 양과 그 때의 pH를 종말점으로 잡기가 어렵다. 좀 더 정확히 실험 을 하기 위해서는 pH가 1~2변하기 전에는 비교적 많이(2~3ml)를 주입하고 그 이후 에는 한 방울 씩 주입하여 색깔변화를 관찰하여야 한다.
- HCl : 10.75
- CH3COOH : 9.57
- 강산인 HCl은 용해되자마자 이온화하여 모두 와 상태로 존재하고 NaOH 첨가시 바로 반응하여 종말점에서 NaCL이라는 중성염이 만들어진다. 하지만 CH3COOH는 약산이어서 용해되면 아주 일부가 인온화하고 원래물질과 화학 평형을 이루어 NaOH 첨가시 비교적 반응이 늦고 종말점에서 라는 염기성 염이 만들어지기 때문이다.
4) CH3COOH의 이온화상수(산해리상수)를 구하라.
=>
5. 실험 고찰
=> 이번 실험은 산-염기 중화적정 실험을 통하여 미지의 산의 농도를 구하였다. 염산 과 식초를 둘 다 20ml씩 떠와서 0.1N의 수산화나트륨으로 중화 적정을 하였다. 염산 은 19ml를 청가했을 때, 식초는 24.5ml를 첨가했을 때, 염산은 주황색에서 노란색으 로, 식초는 무색에서 붉은색으로 바뀌었다. 지시약의 색깔이 갑자기 변화는 지점을 종 말점이라고 생각하고 염산과 식초의 몰농도를 구했을 때, 염산은 0.095M, 식초는 0.1225M였다. 의 공식을 써서 각각 산의 농도를 구해 오차 백분율을 구 하면 각각 5%, 22.5%로 오차가 났다. 이번 오차의 원인은 색깔 변화와 pH변화에 있 는데, 색이 변하는 것은 순간이기 때문에 불연속적인 수산화나트륨의 투입량을 가지고 서 투입된 NaOH의 양과 그 때의 pH를 종말점으로 잡기가 어렵다. 좀 더 정확히 실험 을 하기 위해서는 pH가 1~2변하기 전에는 비교적 많이(2~3ml)를 주입하고 그 이후 에는 한 방울 씩 주입하여 색깔변화를 관찰하여야 한다.
추천자료
 미국의 신보수주의 / 중국의 중화민족주의
미국의 신보수주의 / 중국의 중화민족주의 [산염기적정] 산-염기 적정 실험
[산염기적정] 산-염기 적정 실험 일반화학 실험: 생활속의 산-염기 분석 (산염기 적정)
일반화학 실험: 생활속의 산-염기 분석 (산염기 적정) [화학실험] 중화적정실험(예비+결과레포트)
[화학실험] 중화적정실험(예비+결과레포트) [산 염기][산 염기 정의][아레니우스][펄슨]아레니우스의 산 염기 정의, 펄슨의 산 염기 정의...
[산 염기][산 염기 정의][아레니우스][펄슨]아레니우스의 산 염기 정의, 펄슨의 산 염기 정의... pH, 산도 및 알칼리도 - pH의 정의와 산도 및 알칼리도의 정의를 알고 실험을 하여 그 의미를...
pH, 산도 및 알칼리도 - pH의 정의와 산도 및 알칼리도의 정의를 알고 실험을 하여 그 의미를... 산, 염기의 적정 - 지시약을 이용한 산-염기의 적정을 통해서 적정법을 이해하고 농도를 모르...
산, 염기의 적정 - 지시약을 이용한 산-염기의 적정을 통해서 적정법을 이해하고 농도를 모르... (예비) 알칼리소비량 - 검수중에 함유된 강산,유기산,염류등을 중화하는데 소비되는 알칼리 ...
(예비) 알칼리소비량 - 검수중에 함유된 강산,유기산,염류등을 중화하는데 소비되는 알칼리 ... [화학실험] 알카리 소비량 - 검수중에 함유된 강산, 유기산, 염류 등을 중화하는데 소비되는 ...
[화학실험] 알카리 소비량 - 검수중에 함유된 강산, 유기산, 염류 등을 중화하는데 소비되는 ... 청소년비행의 사회통제이론적 관점(중화이론, 봉쇄이론, 사회유대이론, 억제이론, 사회해체이론)
청소년비행의 사회통제이론적 관점(중화이론, 봉쇄이론, 사회유대이론, 억제이론, 사회해체이론) [소비자상표자산][브랜드자산]소비자상표자산(소비자브랜드자산)의 의미, 소비자상표자산(소...
[소비자상표자산][브랜드자산]소비자상표자산(소비자브랜드자산)의 의미, 소비자상표자산(소... [화학실험] 알칼리 소비량 : 수중에 함유된 강산, 유기산, 염류 등을 중화하는데 소비되는 알...
[화학실험] 알칼리 소비량 : 수중에 함유된 강산, 유기산, 염류 등을 중화하는데 소비되는 알... 식품 분석학 실험 보고서 - 식초 중의 초산 정량(중화 적정)
식품 분석학 실험 보고서 - 식초 중의 초산 정량(중화 적정) [과학 교수-학습 과정안] 산과 염기의 성질 {중학교 지도안/발생(생성)학습/산과 염기/과학/...
[과학 교수-학습 과정안] 산과 염기의 성질 {중학교 지도안/발생(생성)학습/산과 염기/과학/...

























소개글