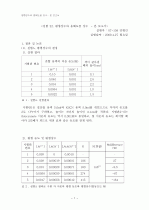
|
서 칼슘이온이 침전되는 역반응이 일어난다. 결과적으로 농도가 더 높은 수산화나트륨 용액일 수록 더 적은 칼슘 이온 농도를 보였다.
3). 각 용액에서의 용해도곱을 비교하고, 용해도곱이 상수임을 알아보자. 실험에서 얻은 값과 문헌에서 조
|
- 페이지 7페이지
- 가격 1,200원
- 등록일 2009.10.09
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
수산화나트륨은 위험하다.
6. 참고 문헌
[1]. 옥스토비 6판 Principle of modern chemistry chp14.2 The empirical law of mass action 발췌(p.574)
표준 일반화학 실험 제6개정판 실험22. 평형상수와 용해도 곱 상수 1. 실험 목적
2. 실험 원리
3. 시약과 실험 기
|
- 페이지 5페이지
- 가격 1,000원
- 등록일 2009.10.09
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
65 mL
0.0666
0.0166
0.0083
3.68 × 10-5
0.025M NaOH
13.30 mL
0.0532
0.0282
0.0141
3.99 × 10-5
평 균
4.58 × 10-5
3. Discussion
(1) 실험 데이터를 통해 알아본 용해도곱 상수에 대한 고찰
실제 수산화칼슘의 용해도곱 상수 값을 알지 못하는 관계로 이 실험결과가 옳은지
|
- 페이지 3페이지
- 가격 1,300원
- 등록일 2013.09.29
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
실험목적
수산화칼슘으로 포화된 용액에 수산화이온을 넣어주면 공통이온효과에 의해 의 농도가 감소된다. 본 실험에서는 이러한 원리를 이용하여 수산화칼슘의 용해도곱상수를 결정하는 방법을 알아본다.
2.이론적 고찰
용해도보다
|
- 페이지 3페이지
- 가격 800원
- 등록일 2023.11.28
- 파일종류 워드(doc)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|

|
칼슘이온의 농도가 낮아야 하는 이유는 NaOH가 해리하여 생긴 OH-이온이 공통이온으로서 작용하기 때문에 수산화칼슘의 용해도가 감소하기 때문이다. 이를 공통이온효과라 한다.
오차의 원인을 살펴보면, 4번 나눠하는 실험 중 처음 한 실험의
|
- 페이지 8페이지
- 가격 2,000원
- 등록일 2010.03.09
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|