|
이온과 칼슘이온 농도를 계산, 용해도곱상수를 계산했으나, 좋은 결과를 얻지는 못했다.
3. 참고문헌
[1]. JChemEd.chem.wisc.edu Vol. 75 No. 1 January 1998 Journal of Chemical Education에서 평형상수값 발췌
[2]. http://en.wikipedia.org/wiki/Solubility_equilibrium 에서 용해
|
- 페이지 7페이지
- 가격 1,200원
- 등록일 2009.10.09
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
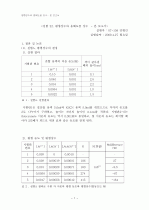
용해도곱상수결정)
1. 원리
1) 균일 평형과 불균일 평형
2) 이 반응에 관여된 화학반응식
3) 공통이온 효과
4) Ksp
2. 실험방법
Ⅲ. 화학실험 사례3(산소요구량)
1. 실험제목
2. 실험목적
3. 관계 지식
4. 실험방법
1) 중크롬산칼륨에 의한 화
|
- 페이지 16페이지
- 가격 6,500원
- 등록일 2011.03.23
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
평형상수: 평형 상태에 있는 반응물과 생성물의 농도(기체인 경우 부분압력)의 비이며, 평형에 있기만 하면 초기 상태에 관계없이 그 값은 같다. 실험 제목
실험 목표
실험 준비물
이론
실험 방법
실험결과의 처리
참고문헌
|
- 페이지 3페이지
- 가격 700원
- 등록일 2011.09.01
- 파일종류 워드(doc)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
평형 상수, 용해도곱, 운반율 등의 측정이 있다. 전극 반응에서 반응 속도의 연구로부터 많은 정보를 얻을 수 있다. 특히 과전압 현상과 관련된 분야가 중요하다.
전기를 방출할 수 있는 화학 에너지를 저장한 장치를 전지라 한다.1차 전지는
|
- 페이지 18페이지
- 가격 1,000원
- 등록일 2005.05.12
- 파일종류 한글(hwp)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|

|
평형 0.00256-0.0004375 0.001-0.0004375 0.0004375
(24) C=3.5cm x 0.001M / 8cm = 0.0004375
(25) 0.00256-0.0004375 = 0.0021225
(26) 0.001-0.0004375 = 0.0005625
(27) K= 0.0004375/0.0021225x0.0005625 = 336
8.고찰
실험에서 오차가 많이 나온 이유가.
용해도곱 상수결정과 같은 실험을 할 때는
|
- 페이지 6페이지
- 가격 1,500원
- 등록일 2008.11.06
- 파일종류 한글(hwp)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|