본문내용
.137mL)
KI의 질량 = 100.137ml × 0.232g / 24.993ml = 0.930g
KCl의 질량 =100.137ml ×0.110g / 24.993ml = 0.441g
100.137mL 내 미지시료 무게는 1.371g이다.
◆ 실험 고찰
이번 실험은 할로겐화물의 혼합물을로 적정하여 혼합물에서 각 염의 양을 측정해 내는 실험이었다. KI와 KCl 혼합물의 를로 적정함으로 용해도 차이를 이용하여 전위차를 측정, 종말점을 구하여 미지시료 속의 두 혼합물의 질량을 분석할 수 있다.
여기서 이다. 그러므로 용해도곱상수가 작은 AgI가 먼저 형성되기 때문에 첫 번째 종말점은 AgI의 침전을, 두 번째 당량점은 KCl의 침전을 나타낸다.
이 번 실험은 전위차법에 의한 침전 적정이라고 할 수 있다. 이는 좁은 뜻으로는 적정의 종말점을 전압 또는 전류에 의하여 지시하는 것만을 가리키고, 넓은 뜻으로는 전도도를 이용하는 적정법, 고주파를 이용하는 적정법도 포함한다. 실험에서 지시전극은 은전극을 사용하고 기준전극은 유리전극을 사용했다. 지시전극은 분석하고자 하는 물질의 활동도에 감응하고 기준전극은 고정된 전위를 가지고 있다.
이번 실험에서 사용한 유리전극은 pH 측정용이다.
→ pH를 측정하는데 사용되는 전형적인 전지
→ 유리 지시전극과 은-염화은 또는 포화 칼로멜 기준전극이 pH를 측정하려는 용액에 담겨있음
→ 유리전극은 pH에 감응하는 얇은 유리막을 두꺼운 유리관 또는 플라스틱관의 끝에 붙여 만듬
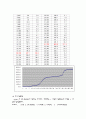
이번 실험을 하면서 전위가 변하는 점에 따라 적정곡선을 그려보면 종말점을 쉽게 알아 볼 수 있었다.
KI의 질량 = 100.137ml × 0.232g / 24.993ml = 0.930g
KCl의 질량 =100.137ml ×0.110g / 24.993ml = 0.441g
100.137mL 내 미지시료 무게는 1.371g이다.
◆ 실험 고찰
이번 실험은 할로겐화물의 혼합물을로 적정하여 혼합물에서 각 염의 양을 측정해 내는 실험이었다. KI와 KCl 혼합물의 를로 적정함으로 용해도 차이를 이용하여 전위차를 측정, 종말점을 구하여 미지시료 속의 두 혼합물의 질량을 분석할 수 있다.
여기서 이다. 그러므로 용해도곱상수가 작은 AgI가 먼저 형성되기 때문에 첫 번째 종말점은 AgI의 침전을, 두 번째 당량점은 KCl의 침전을 나타낸다.
이 번 실험은 전위차법에 의한 침전 적정이라고 할 수 있다. 이는 좁은 뜻으로는 적정의 종말점을 전압 또는 전류에 의하여 지시하는 것만을 가리키고, 넓은 뜻으로는 전도도를 이용하는 적정법, 고주파를 이용하는 적정법도 포함한다. 실험에서 지시전극은 은전극을 사용하고 기준전극은 유리전극을 사용했다. 지시전극은 분석하고자 하는 물질의 활동도에 감응하고 기준전극은 고정된 전위를 가지고 있다.
이번 실험에서 사용한 유리전극은 pH 측정용이다.
→ pH를 측정하는데 사용되는 전형적인 전지
→ 유리 지시전극과 은-염화은 또는 포화 칼로멜 기준전극이 pH를 측정하려는 용액에 담겨있음
→ 유리전극은 pH에 감응하는 얇은 유리막을 두꺼운 유리관 또는 플라스틱관의 끝에 붙여 만듬
이번 실험을 하면서 전위가 변하는 점에 따라 적정곡선을 그려보면 종말점을 쉽게 알아 볼 수 있었다.
키워드
추천자료
 물리화학
물리화학 환경화학 Chemistry in Context
환경화학 Chemistry in Context  화학실험-산과 염기, 산염기적정과 pH 변화, 산해리상수 (당량점, 종말점, 몰농도, 노르말농...
화학실험-산과 염기, 산염기적정과 pH 변화, 산해리상수 (당량점, 종말점, 몰농도, 노르말농... [화학공학]고체로의 용액의 흡착 실험(결과)보고서
[화학공학]고체로의 용액의 흡착 실험(결과)보고서 [일반화학실험] 평형상수의 결정
[일반화학실험] 평형상수의 결정 유기화학 (예비) 추출에 의한 분리; 카페인 추출
유기화학 (예비) 추출에 의한 분리; 카페인 추출 [화학및실험] (예비+결과) 기체의 확산법칙 확인 - 다양한 방법으로 분자량이 다른 기체들의 ...
[화학및실험] (예비+결과) 기체의 확산법칙 확인 - 다양한 방법으로 분자량이 다른 기체들의 ... 화학실험 - 분자량 측정 실험
화학실험 - 분자량 측정 실험 식품화학실험A+)요오드가 측정, IV가 측정
식품화학실험A+)요오드가 측정, IV가 측정 【식품화학실험】 06 - 유지의 산가, 과산화물가
【식품화학실험】 06 - 유지의 산가, 과산화물가 【식품화학실험】 07 - 유지의 TBA값 측정
【식품화학실험】 07 - 유지의 TBA값 측정  【식품화학실험】 03 - 조지방 측정 실험 Soxhlet법 (과제 탈지면, 지질정량법, 지질의 기초 ...
【식품화학실험】 03 - 조지방 측정 실험 Soxhlet법 (과제 탈지면, 지질정량법, 지질의 기초 ... 【식품화학실험】 02 - 산도 알칼리도 측정 (과제 산도,알칼리도 측정법, Factor, 몰농동, 노...
【식품화학실험】 02 - 산도 알칼리도 측정 (과제 산도,알칼리도 측정법, Factor, 몰농동, 노... 【식품화학실험】 12 - 조단백(crude protein) (Kejldal법을 이용한 조단백 측정)
【식품화학실험】 12 - 조단백(crude protein) (Kejldal법을 이용한 조단백 측정)


























소개글