본문내용
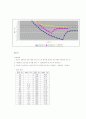
실험에서 처음부터 젓개로 계속 저어주는데도 불구하고 과냉각이 되는 이유는, 젓개로 저어준다 하더라도 용질과 용매의 결합 영향으로 과냉각 되는 것 같다. 그러나 어느 온도 이하가 되면 과냉각 상태가 더 이상 버티기 힘들 정도로 불안정해 지기 때문에, 그 이후에는 다시 온도가 올라가면서 용액이 어는 것이라고 추측한다.
실험상의 과정 말고도 계산상의 과정에서 오차가 일어날 수도 있다. 어는점 내림을 통해서 몰랄농도를 구하고, 또 분자량을 계산하는 과정에서, 소수점 셋째자리에서 반올림을 하였다. 워낙 작은 수라 큰 지장은 안줄지도 모르겠지만, 오차가 발생하는 원인 중의 하나임은 부인할 수는 없다.
좀더 정확한 실험을 하기 위해서는 오차 원인을 제거하는 것이 최선책이라 생각한다. 비록 계산상의 과정, 즉 반올림을 통한 오차는 어쩔 수 없다고 하더라도 온도를 측정하는 부분이라든지 질량 측정하는 부분에서 좀더 정확하게 측정하고, 또 여러 번 반복실험을 통해서 좀더 많은 데이터를 얻는다면, 실제 분자량에 더욱 가까운 결과 값이 나오지 않을까 생각한다.
같은 몰랄농도로 실험한다면, 이론상으로는 소금의 어는점 내림이 비타민C보다 정확히 2배가 되어야 한다. 이유를 말하자면, 소금은 NaCl 으로 전해질이다. 따라서 물에 녹을 경우, Na+ 이온과 Cl- 이온으로 분리된다. 비전해질인 비타민C는 용액에 녹아도 그대로 있으므로, 용액에 녹아있는 물질의 입자 수는 소금이 비타민C보다 2배 많아진다. 어는점 내림은 T = Kf × m 라는 식에서 볼 수 있는 것처럼 물질의 입자수, 즉 몰수에 비례하기 때문에 소금의 어는점 내림이 비타민C의 2배가 되는 것이다.
하지만 실험에서는 이론처럼 정확한 값이 나오지는 않았다. 이 실험에서의 오차의 원인도 앞서 말한 바와 다르지 않다.
Reference
1) Principles of Modern Chemistry, 4th Ed. , Oxtoby & Nachtrieb; 6.4 Collogative Properties of solutions, Freezing-point depression.
2) 일반화학 홈페이지, http://chem1.snu.ac.kr/~chemlab/exp/exp4.htm
3) 텍스트 화학, 김영순심국석김대수, 디딤돌, 2001, p 38, 328-330
4) http://chem.skku.ac.kr/~wiki/main/물리화학실험자료/어는점_내림과_분자량_결정.hwp
실험상의 과정 말고도 계산상의 과정에서 오차가 일어날 수도 있다. 어는점 내림을 통해서 몰랄농도를 구하고, 또 분자량을 계산하는 과정에서, 소수점 셋째자리에서 반올림을 하였다. 워낙 작은 수라 큰 지장은 안줄지도 모르겠지만, 오차가 발생하는 원인 중의 하나임은 부인할 수는 없다.
좀더 정확한 실험을 하기 위해서는 오차 원인을 제거하는 것이 최선책이라 생각한다. 비록 계산상의 과정, 즉 반올림을 통한 오차는 어쩔 수 없다고 하더라도 온도를 측정하는 부분이라든지 질량 측정하는 부분에서 좀더 정확하게 측정하고, 또 여러 번 반복실험을 통해서 좀더 많은 데이터를 얻는다면, 실제 분자량에 더욱 가까운 결과 값이 나오지 않을까 생각한다.
같은 몰랄농도로 실험한다면, 이론상으로는 소금의 어는점 내림이 비타민C보다 정확히 2배가 되어야 한다. 이유를 말하자면, 소금은 NaCl 으로 전해질이다. 따라서 물에 녹을 경우, Na+ 이온과 Cl- 이온으로 분리된다. 비전해질인 비타민C는 용액에 녹아도 그대로 있으므로, 용액에 녹아있는 물질의 입자 수는 소금이 비타민C보다 2배 많아진다. 어는점 내림은 T = Kf × m 라는 식에서 볼 수 있는 것처럼 물질의 입자수, 즉 몰수에 비례하기 때문에 소금의 어는점 내림이 비타민C의 2배가 되는 것이다.
하지만 실험에서는 이론처럼 정확한 값이 나오지는 않았다. 이 실험에서의 오차의 원인도 앞서 말한 바와 다르지 않다.
Reference
1) Principles of Modern Chemistry, 4th Ed. , Oxtoby & Nachtrieb; 6.4 Collogative Properties of solutions, Freezing-point depression.
2) 일반화학 홈페이지, http://chem1.snu.ac.kr/~chemlab/exp/exp4.htm
3) 텍스트 화학, 김영순심국석김대수, 디딤돌, 2001, p 38, 328-330
4) http://chem.skku.ac.kr/~wiki/main/물리화학실험자료/어는점_내림과_분자량_결정.hwp
키워드
추천자료
 아스피린의 합성
아스피린의 합성 전지전극과 pH미터
전지전극과 pH미터 타우린[Taurine]에 대한 조사
타우린[Taurine]에 대한 조사  단백질 정량
단백질 정량 단백질 분리정제 및 기능분석: 개요 및 column chromatography 준비
단백질 분리정제 및 기능분석: 개요 및 column chromatography 준비 일반화학 실험: 생활속의 산-염기 분석 (산염기 적정)
일반화학 실험: 생활속의 산-염기 분석 (산염기 적정) DNA와 방사선
DNA와 방사선 [단백질][아미노산][단백질합성]단백질의 정의, 단백질의 구조, 단백질의 분류, 단백질의 기...
[단백질][아미노산][단백질합성]단백질의 정의, 단백질의 구조, 단백질의 분류, 단백질의 기... 아스피린합성실험
아스피린합성실험 3.pectin(펙틴)
3.pectin(펙틴) 이소아밀아세테이트합성결과보고서
이소아밀아세테이트합성결과보고서 [화학및실험1] 아보가드로수의(NA)의 결정 - 친수성과 소수성을갖는 스테아르산이 물 표면에...
[화학및실험1] 아보가드로수의(NA)의 결정 - 친수성과 소수성을갖는 스테아르산이 물 표면에... 생물학 실험 - 단백질 검출 실험(뷰렛 반응과 닌히드린 반응을 통해 아미노산 및 단백질을 검출)
생물학 실험 - 단백질 검출 실험(뷰렛 반응과 닌히드린 반응을 통해 아미노산 및 단백질을 검출) 단백질 정성 및 정량 - 단백질 정성 및 정량(BCA 법) 및 탄수화물 정성 (pre-report)
단백질 정성 및 정량 - 단백질 정성 및 정량(BCA 법) 및 탄수화물 정성 (pre-report)