목차
1.데이터
2.계산 방법 및 데이터 분석
2.결론 및 토의 내용
2.계산 방법 및 데이터 분석
2.결론 및 토의 내용
본문내용
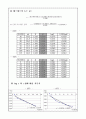
한 기울기
- 25℃ - - 45℃ -
◎ 2.303Log c 와 t 값에 대한 기울기
- 25℃ - - 45℃ -
-추세선에 의해 나온 y함수의 기울기의 절대값이 K
T(K)
1/T
K
logK
298
0.003355704
0.0002
-3.69897
318
0.003144654
0.0006
-3.2211848
y = -2263.8x + 3.8978
기울기 : -2263.8
- 실험식 : logK = -()+1
= - +1
- 계산식 : log =
Ⅴ. 결론 및 토의결과
- 이번 실험은 반응과 온도와의 관계를 살펴보는 것이었다.
이번 실험 결과로는 화학반응 속도는 온도가 올가감에 따라 빨라짐을 알수 있었다. 25℃일때보다 45℃일때의 반응이 활성화 에너지가 작아 반응이 더 빠르게 일어남을 알 수 있었다.
-
- 실험상의 오차가 0.137%로 매우 낮은 오차가 나왔다. 실험시 빠르게 시약을 냉각 시키고, 적정을 주의 깊게 하여 오차가 적게나왔다.
- 물론 그래프에 의한 최소자승법으로 하여 각 데이터에 의한 오차가 있다. 그래프에서 보듯이 데이터의 값이 아래쪽으로 처짐을 보이는데 이는 적정할 때 색깔에 의한 관찰자의 기준의 오차요인이 있다.
- 25℃ - - 45℃ -
◎ 2.303Log c 와 t 값에 대한 기울기
- 25℃ - - 45℃ -
-추세선에 의해 나온 y함수의 기울기의 절대값이 K
T(K)
1/T
K
logK
298
0.003355704
0.0002
-3.69897
318
0.003144654
0.0006
-3.2211848
y = -2263.8x + 3.8978
기울기 : -2263.8
- 실험식 : logK = -()+1
= - +1
- 계산식 : log =
Ⅴ. 결론 및 토의결과
- 이번 실험은 반응과 온도와의 관계를 살펴보는 것이었다.
이번 실험 결과로는 화학반응 속도는 온도가 올가감에 따라 빨라짐을 알수 있었다. 25℃일때보다 45℃일때의 반응이 활성화 에너지가 작아 반응이 더 빠르게 일어남을 알 수 있었다.
-
- 실험상의 오차가 0.137%로 매우 낮은 오차가 나왔다. 실험시 빠르게 시약을 냉각 시키고, 적정을 주의 깊게 하여 오차가 적게나왔다.
- 물론 그래프에 의한 최소자승법으로 하여 각 데이터에 의한 오차가 있다. 그래프에서 보듯이 데이터의 값이 아래쪽으로 처짐을 보이는데 이는 적정할 때 색깔에 의한 관찰자의 기준의 오차요인이 있다.
추천자료
 실험34. 비누화 반응
실험34. 비누화 반응 [예비+결과보고서]실험1. 화학 반응 속도
[예비+결과보고서]실험1. 화학 반응 속도 [예비+결과보고서]실험2. 시계 반응
[예비+결과보고서]실험2. 시계 반응 [실험보고서]효소반응속도론
[실험보고서]효소반응속도론 실험 - 시계반응
실험 - 시계반응 Fe3+와 SCN- 반응 FeSCN2+착이온 농도 비색법 이용 착이온 생성반응의 평형상수 실험
Fe3+와 SCN- 반응 FeSCN2+착이온 농도 비색법 이용 착이온 생성반응의 평형상수 실험 화학 및 실험 II 시계반응 프리젠테이션
화학 및 실험 II 시계반응 프리젠테이션 일반화학 실험 - 반응열의 측정과 Hess의 법칙
일반화학 실험 - 반응열의 측정과 Hess의 법칙 일반화학실험- 화학 반응속도
일반화학실험- 화학 반응속도 물리화학실험 - 화학반응의 온도의존성
물리화학실험 - 화학반응의 온도의존성 알코올의 반응 - 실험목적, 이론 및 원리, 알코올의 분류
알코올의 반응 - 실험목적, 이론 및 원리, 알코올의 분류 [유기화학 실험] 08. p니트로아닐린(p-nitroaniline)의 제조 예비 : 이번 실험은 방향족 니트...
[유기화학 실험] 08. p니트로아닐린(p-nitroaniline)의 제조 예비 : 이번 실험은 방향족 니트... [유기화학 실험] 08. p니트로아닐린(p-nitroaniline)의 제조 결과 : 이번 실험은 방향족 니트...
[유기화학 실험] 08. p니트로아닐린(p-nitroaniline)의 제조 결과 : 이번 실험은 방향족 니트... 화공기초실험, 반응열측정,실험 이론
화공기초실험, 반응열측정,실험 이론

























소개글