목차
1. 서론
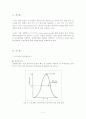
2. 이론
3. 실험장치 및 방법
4. 실험결과 및 고찰
5. 결론
6. 참고문헌
2. 이론
3. 실험장치 및 방법
4. 실험결과 및 고찰
5. 결론
6. 참고문헌
본문내용
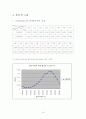
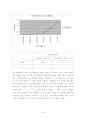
로 고정한 후 시료의 농도를 변화시켜주면서 그에 따른 흡광도의 변화를 측정하는 실험이다. 우선 시료를 0.001M 의 원액에서 시작하여 먼저 측정한 후 원액과 증류수를 어떤 몰 비로 섞어 희석시켜 0.000005M 농도 범위까지 제조하여 흡광도를 측정하였는데, 원액 0.001M에서는 2.100인 가장 큰 흡광도 값을 나타내었고, 농도가 0.0005M , 0.0001M 로 점점 연해질수록 흡광도 값이 감소하였고, 0.000005M인 마지막 실험 농도에서는 가장 작은 0.005의 흡광도 값을 나타내었다. 따라서 우리는 위 1번 실험에서 0.0001M과 0.00005M을 비교 하였을 때 나타난 결과와 마찬가지로 2번 실험도 이와 같은 결론을 얻어낼 수 있는 결과를 얻었다. 즉 1번과 2번 실험을 통해 완전한 결론을 얻을 수 있는데, 이는 농도가 증가하면 증가할수록 이에 따른 흡광도 값도 증가함을 알 수 있다. 이론상으로 농도와 흡광도의 관계를 나타내는 그래프는 농도가 증가하면 증가 할수록 흡광도 값도 커지는 단순 비례관계를 나타내는 선형적인 그래프의 형태를 얻는다.
3. 미지농도의 시료에 대한 흡광도
시료(KMnO4)
0.0001M의 그래프 이용
0.00005M의 그래프 이용
흡광도
0.170
0.170
농 도
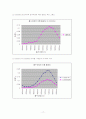
3번 실험에서는 위의 2번 실험에서 나타난 결과 중 임의의 2가지 농도의 용액을 어떤 비율로 섞어서 위 2번 실험 결과의 그래프를 이용하여 임의의 흡광도 값을 통해 그 흡광도에서의 실제 농도를 추정하는 실험이었다. 우리 실험 조는 0.00005M농도와 0.0001M농도의 시료를 1대1의 혼합비로 혼합하여 측정 장치를 통해 흡광도를 측정한 결과 0.170의 값을 얻을 수 있었고, 이를 통해 내삽법이 아닌 2번 실험 결과의 그래프를 그대로 이용하여 자를 대고 눈으로 어림잡아 측정하여 수치를 찾아본 결과
의 값을 얻을 수 있었다. 이 값은 눈으로 어림잡아 구한 값이기 때문에 오차가 상당할 것으로 예상된다. 또한 측정 장치를 통해 측정한 흡광도 값도 아날로그 식이어서 눈으로 읽는 것에 대한 부정확성 또한 무시할 수 없고, 시료를 섞는 과정에서 생기는 문제도 묵인 할 수 없을 것이다.
(참고)
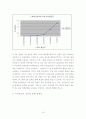
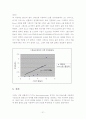
※ 처음에는 Beer의 법칙 A=abc를 이용하여 a,b를 상수(흡광계수 a는 상수이고, 용기의 두께 b는 실험에서 일정하므로)로 하여 간단하게 y=ax 그래프로 만드는 Excel 작업을 통해 그래프의 기울기를 구하고 x를 시료의 몰농도 y를 흡광도로 하여 y=ax의 그래프로 표시하여 흡광도 값에 대한 시료의 몰농도 값을 추정 하려고 하였다. 그래서 Excel 작업을 통해 기울기를 구하니 a=0.2148이란 값이 나왔고 실험측정 결과인 흡광도 값 0.170과 기울기 0.2148을 이용하여 미지수 x값(시료의 몰농도 값)을 구하니 x=0.170/0.2148=0.791433892≒0.7914M 값이 나왔다. 이는 우리가 섞었던 0.0001M과 0.00005M의 농도를 한참 벗어나는 결과를 얻는다. 따라서 이를 적용할 수가 없었다. 아래의 그래프는 참고로 올려 보았다. 그러나 이를 사용하기에는 여러 가지 문제가 있고, 그래서 최종 결과 값에는 대입하지 않았다.
5. 결론
우리는 이번 실험에서 UV/Vis Spectrophotomer 장치와 시료 KMnO4를 이용하여 시료농도와 흡광도의 관계를 통해 최대흡수파장을 결정하고 이를 이용하여 흡광도와 시료의 농도 사이의 관계를 알아볼 수 있었고, 이를 바탕으로 미지농도에 시료에 대한 흡광도 값을 이용하여 실제 농도를 추산해 볼 수 있었던 실험이었다.
먼저 첫 번째 실험을 통해서 시료의 몰농도를 일정하게 했을 때 시료의 최대 흡수파장 영역을 흡광도 값으로 추정한 결과 어느 농도든 간에 530nm의 파장 영역에서 최대의 흡광도 값을 나타내는 것을 알 수 있었고, 이를 통해 시료 KMnO4의 최대흡수파장이 530nm 이고, 이는 KMnO4 의 화학적 구조의 특성상 530nm의 범위에서 빛을 가장 많이 흡수한다는 결론을 얻을 수가 있다. 또한 두 번째 실험을 통해서는 최대흡수파장 영역에서 농도가 커질수록 최대흡광도 값도 덩달아 커지는 비례관계가 있음을 확인 할 수 있었다. 마지막으로 이 두 가지 실험을 통해 0.0001M과 0.00005M의 농도를 가지는 시료를 1대 1로 혼합하여 측정한 흡광도 값 0.170을 이용하여 선형적인 그래프의 특성을 이용하여 측정하여
의 값을 얻어 냄을 알 수 있었다. 우리는 이번 실험을 통해서 UV/Vis Spectrophotomer 장치를 이용하여 시료의 흡광도를 측정함으로서 분광분석기 특성과 시료처리를 어떤 비율로 섞어야 하는지에 대한 처리 기법과 물질의 농도와 빛의 흡수량과의 상호작용을 통한 정량분석법을 이해 할 수 있었다. 시료농도의 정량을 분석하는데 유용하게 쓰이는 법칙은 Beer의 법칙인데 이는 A=abc이다. 여기서 a는 흡광계수 (Absorptivity) , b는 용기의 두께로서 단위는 cm , c는 용액의 몰농도 이다. 우리가 실험할 때에는 용기의 크기는 고정되어 있었으므로 흡광도 A는 농도 c와 직접적인 비례관계가 있다. 따라서 실험을 통해서도 이를 직접적으로 확인 할 수 있었고, 실험결과도 이를 증명하는 결과로 나타내었다. 다만 측정 장치가 디지털식이 아닌 아날로그식이어서 눈으로 읽는데 약간의 오차를 유발하였고, 시료를 섞는 과정에서 약간의 불순물이 들어가 이론상에 데이터 값과 많은 오차를 낸 것이 아쉽게 생각되어 진다. 그러나 이번 실험은 우리가 앞으로 어떤 물질을 정성적 혹은 정량적으로 분석할 때 좋은 참고가 될 것이고, 분광 분석기를 어떻게 이해하고 사용해야 하는지에 대한 좋은 지식을 주는 유익한 실험이었다.
6. 참고문헌
전남대학교 공과대학 화학공학부 , “화학공학실험2”
(참고 site)
http://cafe.daum.net/tonggwan
http://blog.daum.net/eveninhisyouth/4850414
http://www.chemmate.com/chem2
http://www.sdikorea.co.kr/exm2.htm
http://k.daum.net/qna/kin/home
3. 미지농도의 시료에 대한 흡광도
시료(KMnO4)
0.0001M의 그래프 이용
0.00005M의 그래프 이용
흡광도
0.170
0.170
농 도
3번 실험에서는 위의 2번 실험에서 나타난 결과 중 임의의 2가지 농도의 용액을 어떤 비율로 섞어서 위 2번 실험 결과의 그래프를 이용하여 임의의 흡광도 값을 통해 그 흡광도에서의 실제 농도를 추정하는 실험이었다. 우리 실험 조는 0.00005M농도와 0.0001M농도의 시료를 1대1의 혼합비로 혼합하여 측정 장치를 통해 흡광도를 측정한 결과 0.170의 값을 얻을 수 있었고, 이를 통해 내삽법이 아닌 2번 실험 결과의 그래프를 그대로 이용하여 자를 대고 눈으로 어림잡아 측정하여 수치를 찾아본 결과
의 값을 얻을 수 있었다. 이 값은 눈으로 어림잡아 구한 값이기 때문에 오차가 상당할 것으로 예상된다. 또한 측정 장치를 통해 측정한 흡광도 값도 아날로그 식이어서 눈으로 읽는 것에 대한 부정확성 또한 무시할 수 없고, 시료를 섞는 과정에서 생기는 문제도 묵인 할 수 없을 것이다.
(참고)
※ 처음에는 Beer의 법칙 A=abc를 이용하여 a,b를 상수(흡광계수 a는 상수이고, 용기의 두께 b는 실험에서 일정하므로)로 하여 간단하게 y=ax 그래프로 만드는 Excel 작업을 통해 그래프의 기울기를 구하고 x를 시료의 몰농도 y를 흡광도로 하여 y=ax의 그래프로 표시하여 흡광도 값에 대한 시료의 몰농도 값을 추정 하려고 하였다. 그래서 Excel 작업을 통해 기울기를 구하니 a=0.2148이란 값이 나왔고 실험측정 결과인 흡광도 값 0.170과 기울기 0.2148을 이용하여 미지수 x값(시료의 몰농도 값)을 구하니 x=0.170/0.2148=0.791433892≒0.7914M 값이 나왔다. 이는 우리가 섞었던 0.0001M과 0.00005M의 농도를 한참 벗어나는 결과를 얻는다. 따라서 이를 적용할 수가 없었다. 아래의 그래프는 참고로 올려 보았다. 그러나 이를 사용하기에는 여러 가지 문제가 있고, 그래서 최종 결과 값에는 대입하지 않았다.
5. 결론
우리는 이번 실험에서 UV/Vis Spectrophotomer 장치와 시료 KMnO4를 이용하여 시료농도와 흡광도의 관계를 통해 최대흡수파장을 결정하고 이를 이용하여 흡광도와 시료의 농도 사이의 관계를 알아볼 수 있었고, 이를 바탕으로 미지농도에 시료에 대한 흡광도 값을 이용하여 실제 농도를 추산해 볼 수 있었던 실험이었다.
먼저 첫 번째 실험을 통해서 시료의 몰농도를 일정하게 했을 때 시료의 최대 흡수파장 영역을 흡광도 값으로 추정한 결과 어느 농도든 간에 530nm의 파장 영역에서 최대의 흡광도 값을 나타내는 것을 알 수 있었고, 이를 통해 시료 KMnO4의 최대흡수파장이 530nm 이고, 이는 KMnO4 의 화학적 구조의 특성상 530nm의 범위에서 빛을 가장 많이 흡수한다는 결론을 얻을 수가 있다. 또한 두 번째 실험을 통해서는 최대흡수파장 영역에서 농도가 커질수록 최대흡광도 값도 덩달아 커지는 비례관계가 있음을 확인 할 수 있었다. 마지막으로 이 두 가지 실험을 통해 0.0001M과 0.00005M의 농도를 가지는 시료를 1대 1로 혼합하여 측정한 흡광도 값 0.170을 이용하여 선형적인 그래프의 특성을 이용하여 측정하여
의 값을 얻어 냄을 알 수 있었다. 우리는 이번 실험을 통해서 UV/Vis Spectrophotomer 장치를 이용하여 시료의 흡광도를 측정함으로서 분광분석기 특성과 시료처리를 어떤 비율로 섞어야 하는지에 대한 처리 기법과 물질의 농도와 빛의 흡수량과의 상호작용을 통한 정량분석법을 이해 할 수 있었다. 시료농도의 정량을 분석하는데 유용하게 쓰이는 법칙은 Beer의 법칙인데 이는 A=abc이다. 여기서 a는 흡광계수 (Absorptivity) , b는 용기의 두께로서 단위는 cm , c는 용액의 몰농도 이다. 우리가 실험할 때에는 용기의 크기는 고정되어 있었으므로 흡광도 A는 농도 c와 직접적인 비례관계가 있다. 따라서 실험을 통해서도 이를 직접적으로 확인 할 수 있었고, 실험결과도 이를 증명하는 결과로 나타내었다. 다만 측정 장치가 디지털식이 아닌 아날로그식이어서 눈으로 읽는데 약간의 오차를 유발하였고, 시료를 섞는 과정에서 약간의 불순물이 들어가 이론상에 데이터 값과 많은 오차를 낸 것이 아쉽게 생각되어 진다. 그러나 이번 실험은 우리가 앞으로 어떤 물질을 정성적 혹은 정량적으로 분석할 때 좋은 참고가 될 것이고, 분광 분석기를 어떻게 이해하고 사용해야 하는지에 대한 좋은 지식을 주는 유익한 실험이었다.
6. 참고문헌
전남대학교 공과대학 화학공학부 , “화학공학실험2”
(참고 site)
http://cafe.daum.net/tonggwan
http://blog.daum.net/eveninhisyouth/4850414
http://www.chemmate.com/chem2
http://www.sdikorea.co.kr/exm2.htm
http://k.daum.net/qna/kin/home
키워드
추천자료
 [물리화학실험] 점성도 실험
[물리화학실험] 점성도 실험 [화학실험] 크로마토그래피 분리 실험
[화학실험] 크로마토그래피 분리 실험 [화학실험] 액체의 밀도와 용량기의 검정 실험
[화학실험] 액체의 밀도와 용량기의 검정 실험 [화학실험] 액체-증기 평형 실험 (예비+결과레포트)
[화학실험] 액체-증기 평형 실험 (예비+결과레포트) [일반화학및실험] 옥살레이트-철 착화합물의 합성과 광화학 반응
[일반화학및실험] 옥살레이트-철 착화합물의 합성과 광화학 반응 [화학공학실험] 레이놀즈(Reynolds) 실험
[화학공학실험] 레이놀즈(Reynolds) 실험 [화학실험보고서] 화학 평형 상수의 결정
[화학실험보고서] 화학 평형 상수의 결정 [분석화학실험] (예비) 순환전압전류법을 이용한 전기적 활성물질의 전기화학적 특성확인
[분석화학실험] (예비) 순환전압전류법을 이용한 전기적 활성물질의 전기화학적 특성확인 [분석화학실험] (예비) 용해성 철 측정 : 수질 시료 중에 녹아있는 철의 농도를 알아보는 실험
[분석화학실험] (예비) 용해성 철 측정 : 수질 시료 중에 녹아있는 철의 농도를 알아보는 실험 [분석화학실험] (예비) 총 인측정-흡광광도법(아스코르빈산 환원법) : 수질 시료 중에 총 인...
[분석화학실험] (예비) 총 인측정-흡광광도법(아스코르빈산 환원법) : 수질 시료 중에 총 인... [일반화학실험] 시계반응 예비보고서 : 시계반응을 이용해서 반응 속도의 차이가 큰 반응단계...
[일반화학실험] 시계반응 예비보고서 : 시계반응을 이용해서 반응 속도의 차이가 큰 반응단계... 【식품화학실험】 05 - 비누화가, 요오드가 측정 실험 (과제 비누화가, 요오드가 정의, blank...
【식품화학실험】 05 - 비누화가, 요오드가 측정 실험 (과제 비누화가, 요오드가 정의, blank... 【식품화학실험】 03 - 조지방 측정 실험 Soxhlet법 (과제 탈지면, 지질정량법, 지질의 기초 ...
【식품화학실험】 03 - 조지방 측정 실험 Soxhlet법 (과제 탈지면, 지질정량법, 지질의 기초 ... ★ 정밀화학제조실험 - 나일론 66의 합성(계면중축합) - 실험보고서
★ 정밀화학제조실험 - 나일론 66의 합성(계면중축합) - 실험보고서






































소개글