본문내용
324.15
978
58.1
175.29477
82
355.15
987
63.2
175.63959
52
325.15
978
58.3
175.35722
83
356.15
987
63.5
175.97782
53
326.15
978
58.5
175.41929
84
357.15
987
63.7
176.03780
54
327.15
978
58.9
176.07886
85
358.15
987
64
176.37303
55
328.15
977
59.0
175.66052
86
359.15
989
64
176.23834
56
329.15
976
59.0
174.94759
87
360.15
992
64
176.28210
57
330.15
979
59.0
174.95381
88
361.15
997
64
176.68005
58
331.15
978
59.2
174.83799
89
362.15
999
64
176.54563
59
332.15
980
59.5
175.55321
90
363.15
1001
64
176.41195
560
333.15
981
59.7
175.79379
91
364.15
1005
64
176.63051
평균 및 표준오차 :
6. 실험 결과
a. Boyle의 법칙()
실험실의 대기압은 이였고, 이때 피스톤의 부피를
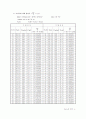
로부터 실험을 시작했다. 부피를 압축하는 과정과 팽창하는 과정에서 부피 변화에 따른 피스톤 내부 압력변화를 측정하였는데, 그 결과는 다음과 같다.
압축과정 :
팽창과정 :
이 두 과정을 통합해서 볼 때, 부피가 감소할수록 값들이 감소하는 경향을 보이고 있었다. 이것은 피스톤이 완전 밀폐가 되지 않았고, 부피가 감소할수록 피스톤 내부의 공기가 빠져나가 내부압력이 축소되어 측정되고, 부피가 증가할수록 피스톤 내부로 공기가 들어와 압력이 높게 측정되었기 때문이라 생각된다.
그리고 두 과정을 통합한 결과는 다음과 같다.
b. 이상기체 상태 방정식 ()
실험실의 대기압은 이였고, 이때 피스톤의 부피를
, 온도를 에서 실험을 시작하였다.
온도를 올리는 가열과정과 반대의 냉각과정을 거치면서 온도변화에 따른 피스톤의 부피와 내부압력을 측정하였다. 그 결과는 다음과 같다.
가열과정 :
냉각과정 :
그리고 두 과정을 통합한 결과는 다음과 같다.
7. 질문 및 토의
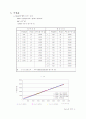
(1) 실험 a에서 와 의 그래프를 그리고 의미를 설명하시오.
위의 그래프에서처럼 축을 로 하고 축을 로 했을 때, 그 기울기가 값에 해당한다. 위 그래프에서 최소자승법을 이용하여, 직선의 방정식을 구해보면 다음과 같고,
여기서 기울기가 우리가 구한 값에 해당하고, 이고, 계산값 와는 큰 차이를 보인다.
따라서 그래프에서 일 때, 인 점을 지나도록 해서 최소자승법으로 기울기를 구해보면, 가 되고, 이것은 계산한 값과 비슷하다.
실험에서 피스톤 안에는 이상기체가 아닌 공기가 들어 있었기 때문에, 분자간 인력이나, 공기분자의 부피가 있음을 고려할 때, 가
보다 더 타당한 것으로 보인다.
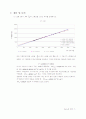
(2) 실험 b에서 와 의 그래프를 그리고 의미를 설명하시오.
위의 그래프에서처럼 축을 로 하고 축을 로 했을 때, 그 기울기가 값에 해당한다. 위 그래프에서 최소자승법을 이용하여, 직선의 방정식을 구해보면 다음과 같고,
(가열과정)
(냉각과정)
여기서 기울기가 우리가 구한 값에 해당하고, , 이고, 계산값 와는 큰 차이를 보인다. 따라서 그래프에서 일 때, 인 점을 지나도록 해서 최소자승법으로 기울기를 구해보면, 가 되고, 이것은 계산한 값과 비슷하다.
실험에서 피스톤 안에는 이상기체가 아닌 공기가 들어 있었기 때문에, 분자간 인력이나, 공기분자의 부피가 있음을 고려할 때, 직접 계산한 값보다는 그래프에서 읽은 값이 더 타당하다.
8. 결론 및 검토
이번 실험은 밀폐된 실린더에 공기를 채운 후 온도, 부피, 압력을 변화시키면서 이상기체 상태방정식을 확인하고, 온도를 일정하게 유지한 채 압력을 변화시키면서 부피를 측정하여 Boyle 법칙을 확인하는 것이다.
보일의 법칙에서 로서 일정한 값을 확인할 수 있었고, 이상기체방정식에서 가 일정한 값을 가짐을 확인할 수 있었다.
하지만, 이상기체에 관하여 계산 한 값들과는 상당한 차이를 보이고 있는데, 이것은 실린더 내부에는 이상기체가 아닌 공기가 채워져 있었고, 따라서 Van der Waals 방정식을 적용하는게 더 타당하다.
여기서 항은 분자력 때문에 나타나는 항이고, 는 분자 자신이 점유하는 체적에 비례하는 것이다.
또한 실린더의 완전밀폐는 불가능 하기때문에 오차가 발생한다.
978
58.1
175.29477
82
355.15
987
63.2
175.63959
52
325.15
978
58.3
175.35722
83
356.15
987
63.5
175.97782
53
326.15
978
58.5
175.41929
84
357.15
987
63.7
176.03780
54
327.15
978
58.9
176.07886
85
358.15
987
64
176.37303
55
328.15
977
59.0
175.66052
86
359.15
989
64
176.23834
56
329.15
976
59.0
174.94759
87
360.15
992
64
176.28210
57
330.15
979
59.0
174.95381
88
361.15
997
64
176.68005
58
331.15
978
59.2
174.83799
89
362.15
999
64
176.54563
59
332.15
980
59.5
175.55321
90
363.15
1001
64
176.41195
560
333.15
981
59.7
175.79379
91
364.15
1005
64
176.63051
평균 및 표준오차 :
6. 실험 결과
a. Boyle의 법칙()
실험실의 대기압은 이였고, 이때 피스톤의 부피를
로부터 실험을 시작했다. 부피를 압축하는 과정과 팽창하는 과정에서 부피 변화에 따른 피스톤 내부 압력변화를 측정하였는데, 그 결과는 다음과 같다.
압축과정 :
팽창과정 :
이 두 과정을 통합해서 볼 때, 부피가 감소할수록 값들이 감소하는 경향을 보이고 있었다. 이것은 피스톤이 완전 밀폐가 되지 않았고, 부피가 감소할수록 피스톤 내부의 공기가 빠져나가 내부압력이 축소되어 측정되고, 부피가 증가할수록 피스톤 내부로 공기가 들어와 압력이 높게 측정되었기 때문이라 생각된다.
그리고 두 과정을 통합한 결과는 다음과 같다.
b. 이상기체 상태 방정식 ()
실험실의 대기압은 이였고, 이때 피스톤의 부피를
, 온도를 에서 실험을 시작하였다.
온도를 올리는 가열과정과 반대의 냉각과정을 거치면서 온도변화에 따른 피스톤의 부피와 내부압력을 측정하였다. 그 결과는 다음과 같다.
가열과정 :
냉각과정 :
그리고 두 과정을 통합한 결과는 다음과 같다.
7. 질문 및 토의
(1) 실험 a에서 와 의 그래프를 그리고 의미를 설명하시오.
위의 그래프에서처럼 축을 로 하고 축을 로 했을 때, 그 기울기가 값에 해당한다. 위 그래프에서 최소자승법을 이용하여, 직선의 방정식을 구해보면 다음과 같고,
여기서 기울기가 우리가 구한 값에 해당하고, 이고, 계산값 와는 큰 차이를 보인다.
따라서 그래프에서 일 때, 인 점을 지나도록 해서 최소자승법으로 기울기를 구해보면, 가 되고, 이것은 계산한 값과 비슷하다.
실험에서 피스톤 안에는 이상기체가 아닌 공기가 들어 있었기 때문에, 분자간 인력이나, 공기분자의 부피가 있음을 고려할 때, 가
보다 더 타당한 것으로 보인다.
(2) 실험 b에서 와 의 그래프를 그리고 의미를 설명하시오.
위의 그래프에서처럼 축을 로 하고 축을 로 했을 때, 그 기울기가 값에 해당한다. 위 그래프에서 최소자승법을 이용하여, 직선의 방정식을 구해보면 다음과 같고,
(가열과정)
(냉각과정)
여기서 기울기가 우리가 구한 값에 해당하고, , 이고, 계산값 와는 큰 차이를 보인다. 따라서 그래프에서 일 때, 인 점을 지나도록 해서 최소자승법으로 기울기를 구해보면, 가 되고, 이것은 계산한 값과 비슷하다.
실험에서 피스톤 안에는 이상기체가 아닌 공기가 들어 있었기 때문에, 분자간 인력이나, 공기분자의 부피가 있음을 고려할 때, 직접 계산한 값보다는 그래프에서 읽은 값이 더 타당하다.
8. 결론 및 검토
이번 실험은 밀폐된 실린더에 공기를 채운 후 온도, 부피, 압력을 변화시키면서 이상기체 상태방정식을 확인하고, 온도를 일정하게 유지한 채 압력을 변화시키면서 부피를 측정하여 Boyle 법칙을 확인하는 것이다.
보일의 법칙에서 로서 일정한 값을 확인할 수 있었고, 이상기체방정식에서 가 일정한 값을 가짐을 확인할 수 있었다.
하지만, 이상기체에 관하여 계산 한 값들과는 상당한 차이를 보이고 있는데, 이것은 실린더 내부에는 이상기체가 아닌 공기가 채워져 있었고, 따라서 Van der Waals 방정식을 적용하는게 더 타당하다.
여기서 항은 분자력 때문에 나타나는 항이고, 는 분자 자신이 점유하는 체적에 비례하는 것이다.
또한 실린더의 완전밀폐는 불가능 하기때문에 오차가 발생한다.




























소개글