목차
예비레포트
1.실험제목
2.실험목적
3.실험원리
4.실험방법
5.참고문헌
결과레포트
1.실험결과
2.고찰
3.질문
1.실험제목
2.실험목적
3.실험원리
4.실험방법
5.참고문헌
결과레포트
1.실험결과
2.고찰
3.질문
본문내용
1
1.07
1
3.14
2
1.08
2
3.44
3
1.08
3
3.66
4
1.08
4
3.82
5
1.08
5
3.95
6
1.11
6
4.05
7
1.13
7
4.16
8
1.16
8
4.26
9
1.19
9
4.34
10
1.23
10
4.43
11
1.26
11
4.52
12
1.30
12
4.61
13
1.35
13
4.70
14
1.42
14
4.80
15
1.49
15
4.91
16
1.58
16
5.03
17
1.70
17
5.18
18
1.87
18
5.36
19
2.19
19
5.58
20
4.90
20
6.00
21
8.84
21
7.18
22
10.99
22
10.61
22.5
11.33
22.5
10.98
23
11.72
23
11.29
23.5
11.67
23.5
11.46
24
11.76
24
11.57
24.5
11.82
24.5
11.60
25
11.87
25
11.66
2)고 찰
산과 염기가 반응하면 정량적으로 중화되어 염과 물이 생성되는데 몇가지 산에 농도를 알고 있는 염기 용액을
가하여 가한 염기의 부피에 따른 pH를 측정해서 산-염기 평형을 관찰하고 미지의 산의 농도와 pKa값을 구하는
것이 이번 실험의 목적이었다.
우리가 사용한 비커의 반경이 작은데 비해서 자석교반바와 pH측정용 전극, 뷰렛의 끝부분을 함께 비커속에
넣기가 어려웠고, 교반바가 돌아가면서 자꾸 부딪혔다.
그리고, 문헌상에 보면 센 산 - 센 염기 적정에는 브롬메틸블루(종말점 pH=7), 메틸 레드(종말점 pH=5), 페
놀프탈레인(종말점 pH=9)를 사용하고, 약한 산 - 센 염기 적정에는 pH 9에서 지시약의 색이 변하므로 페놀
프탈레인(종말점 pH-9)이 적합하고, 메틸 레드(종말점 pH=5)는 적합지 않다. 만일 메틸 레드를 사용할 경우
반응이 약 65%되었을 때 미리 적정이 끝나게 된다. 이러한 경우가 약한 산 - 센 염기 적정의 전형적인 예이다.
이런 적정을 위해서는 약 PH 7에서 색이 변하는 페놀프탈레인 같은 지시약을 사용한다. 센 산 - 약한 염기 적정에는 메틸 레드를 사용한다. 다른 두 지시약은 당량점에 도달하기 전에 너무 일찍 색이 변하게 된다.
질문2의 답을 보면 염산과 식초의 농도차이가 0.0025N밖에 나지 않는데, 이건 좀 이상한 것 같다. 계산이 잘못된
것인지 아니면 우리가 같은 지시약을 사용했기 때문인지 판단하기 어렵다.
3)질 문
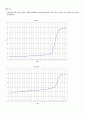
실험 B와 C에서 얻은 결과로 가해준 NaOH의 부피에 대한 pH의 적정 곡선을 그려라. 또한 용액의 색도 함께
표시하여라.
HCl과 식초의 농도를 구하여라.
- 중화반응의 당량점에서는 첨가된 염기의 화학량은 원래 존재하는 산의 화학량과 같으므로 다음 식이 성립한다.
N V = N' V'
(N → 산의 농도, V → 산의 부피, N', V'는 농도가 N인 산 V㎖를 중화하는데 소비된 염기의 농도, 부피)
따라서 HCl의 경우, 당량점(pH=7)에서의 NaOH양은 20.5㎖이다.
N V = N' V'에 대입하여,
N X 20 = 0.1 X 20.5
따라서 0.1025 N HCl
CH₃COOH의 경우, 당량점(pH=7)에서의 NaOH양은 22㎖이다.
N V = N' V'에 대입하여,
N X 20 = 0.1 X 21
따라서 0.105 N CH₃COOH
센 산인 HCl을 센 염기인 NaOH로 적정했을 때와 약산인 CH₃COOH를 센 염기인 NaOH로 적정했을 때
종말점에서의 ⅰ)pH는 얼마인가? 또 ⅱ)두 경우에 적정곡선의 모양이 다른 이유는 무엇인가?
ⅰ) 센 산 - 센 염기 : pH = 8.84
약 산 - 센 염기 : pH = 10.61
ⅱ) HCl + NaOH에서 HCl은 강산이므로 물에서 완전 이온화된다.
에서 분자가 커지므로 Ka값 즉, 해리상수가 커진다.
따라서, NaOH로 적정했을 때 가 약산보다 많이 든다.
그래서 적정곡선이 달라진다.
CH₃COOH의 이온화상수(산해리상수)를 구하여라.
CH₃COOH ⇔ +
Ka = = 1.76 X
산의 농도를 지시약의 종말점으로 구한 것과 pH 미터에 의한 방법(당량점)으로 구할 때의 오차를 계산해 보라.
→ HCl의 경우 : 종말점 - 0.095 N, 당량점 - 0.1025 N 오차 - 0.0075 N
→ CH₃COOH의 경우 : 종말점 - 0.1 N, 당량점 - 0.105 N 오차 - 0.005 N
→ 종말점과 당량점간에 오차가 생기는 이유는 지시약은 작용하는 범위가 넓어서 여러 pH값에서 계속
색이 변하므로 정확한 종말점 측정이 어렵기 때문이다.
1.07
1
3.14
2
1.08
2
3.44
3
1.08
3
3.66
4
1.08
4
3.82
5
1.08
5
3.95
6
1.11
6
4.05
7
1.13
7
4.16
8
1.16
8
4.26
9
1.19
9
4.34
10
1.23
10
4.43
11
1.26
11
4.52
12
1.30
12
4.61
13
1.35
13
4.70
14
1.42
14
4.80
15
1.49
15
4.91
16
1.58
16
5.03
17
1.70
17
5.18
18
1.87
18
5.36
19
2.19
19
5.58
20
4.90
20
6.00
21
8.84
21
7.18
22
10.99
22
10.61
22.5
11.33
22.5
10.98
23
11.72
23
11.29
23.5
11.67
23.5
11.46
24
11.76
24
11.57
24.5
11.82
24.5
11.60
25
11.87
25
11.66
2)고 찰
산과 염기가 반응하면 정량적으로 중화되어 염과 물이 생성되는데 몇가지 산에 농도를 알고 있는 염기 용액을
가하여 가한 염기의 부피에 따른 pH를 측정해서 산-염기 평형을 관찰하고 미지의 산의 농도와 pKa값을 구하는
것이 이번 실험의 목적이었다.
우리가 사용한 비커의 반경이 작은데 비해서 자석교반바와 pH측정용 전극, 뷰렛의 끝부분을 함께 비커속에
넣기가 어려웠고, 교반바가 돌아가면서 자꾸 부딪혔다.
그리고, 문헌상에 보면 센 산 - 센 염기 적정에는 브롬메틸블루(종말점 pH=7), 메틸 레드(종말점 pH=5), 페
놀프탈레인(종말점 pH=9)를 사용하고, 약한 산 - 센 염기 적정에는 pH 9에서 지시약의 색이 변하므로 페놀
프탈레인(종말점 pH-9)이 적합하고, 메틸 레드(종말점 pH=5)는 적합지 않다. 만일 메틸 레드를 사용할 경우
반응이 약 65%되었을 때 미리 적정이 끝나게 된다. 이러한 경우가 약한 산 - 센 염기 적정의 전형적인 예이다.
이런 적정을 위해서는 약 PH 7에서 색이 변하는 페놀프탈레인 같은 지시약을 사용한다. 센 산 - 약한 염기 적정에는 메틸 레드를 사용한다. 다른 두 지시약은 당량점에 도달하기 전에 너무 일찍 색이 변하게 된다.
질문2의 답을 보면 염산과 식초의 농도차이가 0.0025N밖에 나지 않는데, 이건 좀 이상한 것 같다. 계산이 잘못된
것인지 아니면 우리가 같은 지시약을 사용했기 때문인지 판단하기 어렵다.
3)질 문
실험 B와 C에서 얻은 결과로 가해준 NaOH의 부피에 대한 pH의 적정 곡선을 그려라. 또한 용액의 색도 함께
표시하여라.
HCl과 식초의 농도를 구하여라.
- 중화반응의 당량점에서는 첨가된 염기의 화학량은 원래 존재하는 산의 화학량과 같으므로 다음 식이 성립한다.
N V = N' V'
(N → 산의 농도, V → 산의 부피, N', V'는 농도가 N인 산 V㎖를 중화하는데 소비된 염기의 농도, 부피)
따라서 HCl의 경우, 당량점(pH=7)에서의 NaOH양은 20.5㎖이다.
N V = N' V'에 대입하여,
N X 20 = 0.1 X 20.5
따라서 0.1025 N HCl
CH₃COOH의 경우, 당량점(pH=7)에서의 NaOH양은 22㎖이다.
N V = N' V'에 대입하여,
N X 20 = 0.1 X 21
따라서 0.105 N CH₃COOH
센 산인 HCl을 센 염기인 NaOH로 적정했을 때와 약산인 CH₃COOH를 센 염기인 NaOH로 적정했을 때
종말점에서의 ⅰ)pH는 얼마인가? 또 ⅱ)두 경우에 적정곡선의 모양이 다른 이유는 무엇인가?
ⅰ) 센 산 - 센 염기 : pH = 8.84
약 산 - 센 염기 : pH = 10.61
ⅱ) HCl + NaOH에서 HCl은 강산이므로 물에서 완전 이온화된다.
에서 분자가 커지므로 Ka값 즉, 해리상수가 커진다.
따라서, NaOH로 적정했을 때 가 약산보다 많이 든다.
그래서 적정곡선이 달라진다.
CH₃COOH의 이온화상수(산해리상수)를 구하여라.
CH₃COOH ⇔ +
Ka = = 1.76 X
산의 농도를 지시약의 종말점으로 구한 것과 pH 미터에 의한 방법(당량점)으로 구할 때의 오차를 계산해 보라.
→ HCl의 경우 : 종말점 - 0.095 N, 당량점 - 0.1025 N 오차 - 0.0075 N
→ CH₃COOH의 경우 : 종말점 - 0.1 N, 당량점 - 0.105 N 오차 - 0.005 N
→ 종말점과 당량점간에 오차가 생기는 이유는 지시약은 작용하는 범위가 넓어서 여러 pH값에서 계속
색이 변하므로 정확한 종말점 측정이 어렵기 때문이다.
추천자료
 아미노산의 적정
아미노산의 적정 아미노산의 적정
아미노산의 적정 중화 적정법을 이용한 귤, 사과, 포도주스, 오렌지주스의 유기산 정량
중화 적정법을 이용한 귤, 사과, 포도주스, 오렌지주스의 유기산 정량 산과염기
산과염기 염기 표준용액 만들기(2차 표준용액)
염기 표준용액 만들기(2차 표준용액) 인산의 적정과 완충 용액
인산의 적정과 완충 용액 [화학실험](예비)인산의 적정과 완충용액
[화학실험](예비)인산의 적정과 완충용액 [화학실험] 이온화 상수 결정실험(전위차 적정)
[화학실험] 이온화 상수 결정실험(전위차 적정) [일반화학실험][예비+결과] 인산의 적정과 완충용액 실험
[일반화학실험][예비+결과] 인산의 적정과 완충용액 실험 [화학, 중화적정 반응속도, Kjeldhl질소정량법(켈달법, 킬달법), 암모니아]화학의 역사, 화학...
[화학, 중화적정 반응속도, Kjeldhl질소정량법(켈달법, 킬달법), 암모니아]화학의 역사, 화학... Chapter 3. 자동적정 (Auto titration)을 이용한 중화반응 측정
Chapter 3. 자동적정 (Auto titration)을 이용한 중화반응 측정 산과염기neutralization titration실험 예비보고서
산과염기neutralization titration실험 예비보고서 산과염기
산과염기






























소개글