목차
1. 서 론
1. 1 Trypsin이란 ?
1. 2 실험 목적
2. 이론적 배경
2. 1 일반적인 효소반응속도 실험원리
2. 1. 1 효소
2. 1. 2 효소의 특이성
2. 1. 3 효소의 작용에 영향을 주는 요소
2. 2 화학반응역학
2. 2.. 1 질량작용의 법칙
2. 2. 2 반응차수와 실험반응식 p
2. 3 Enzyme kinetics
2. 3. 1 Michaelis-Menten Plot
2. 3. 2 Simple Enzyme Kinetics
2. 4 가역적 저해
2. 4. 1 경쟁적 저해 (reversible inhibition)
2. 4. 2 비경쟁적 저해 (Non-competitive inhibition)
2. 4. 3 무경쟁적 저해 (Uncompetitive inhibition)
2. 5 온도의 영향
2. 6 pH의 영향
2. 7 Trypsin의 화학적 기능
2. 8 시약과 기구
3. 실험 방법
Nomenclatures
References
Appendix
그림 차례
Figure 1.1
Figure 2.1
Figure 2.2
Figure 2.3
Figure 2.4
Figure 2.5
Figure 2.6
Figure 2.7
Figure 2.8
1. 1 Trypsin이란 ?
1. 2 실험 목적
2. 이론적 배경
2. 1 일반적인 효소반응속도 실험원리
2. 1. 1 효소
2. 1. 2 효소의 특이성
2. 1. 3 효소의 작용에 영향을 주는 요소
2. 2 화학반응역학
2. 2.. 1 질량작용의 법칙
2. 2. 2 반응차수와 실험반응식 p
2. 3 Enzyme kinetics
2. 3. 1 Michaelis-Menten Plot
2. 3. 2 Simple Enzyme Kinetics
2. 4 가역적 저해
2. 4. 1 경쟁적 저해 (reversible inhibition)
2. 4. 2 비경쟁적 저해 (Non-competitive inhibition)
2. 4. 3 무경쟁적 저해 (Uncompetitive inhibition)
2. 5 온도의 영향
2. 6 pH의 영향
2. 7 Trypsin의 화학적 기능
2. 8 시약과 기구
3. 실험 방법
Nomenclatures
References
Appendix
그림 차례
Figure 1.1
Figure 2.1
Figure 2.2
Figure 2.3
Figure 2.4
Figure 2.5
Figure 2.6
Figure 2.7
Figure 2.8
본문내용
temperature)라 한다.(Figure 2.6 및 2.7 참조)
2.6 pH의 영향
효소는 한정된 범위의 pH에서만 활성이 있으며 이 범위내에서 효소의 안정성이 나타나고 반응속도가 최대로 되는 최적pH(optimum pH)를 가진다. 양극단의 pH에서는 효소의 촉매부위가 파괴되기도 한다. 최적pH에서는 효소 촉매부위의 proton 공여기 및 수용기, 효소-기질 복합체 그리고 기질이 적당한 이온화 상태로 되어 기질과의 친화성이 증가되므로 반응속도가 최대로 된다.
효소는 기질에 따라서 최적 pH가 변화하기도 하며 ATP, NAD+, 아미노산, coenzyme A 등과 같이 기질이 전해질인 경우에는 이들이 일정한 이온형이 아니면 효소는 작용하지 않는다. 세포내에서는 각 부위의 pH가 정확하게 유지되며 그 pH 조절기구는 세포의 대사조절과 밀접한 관계가 있다.
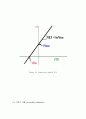
Figure 2.5 무경쟁적 저해(uncompetitive inhibition)
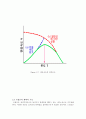
Figure 2.6 반응속도와 시간, 온도와의 관계
Figure 2.7 반응속도의 최적온도
2.7 트립신의 화학적 기능
트립신은 십이지장속으로 들어가서 단백질을 펩티드 또는 아미노산으로 가수분해한다. 이러한 작용은 음식안의 단백질을 섭취하는데 꼭 필요한 작용이다. 드립신은 펩티드 결합의 가수분해를 촉진시킨다. 이러한 효소반응은 다른모든 프로테아제와 비슷하다. 이러한 촉매는 활동하는 영역을 serine nucleophile로 작용시킨다. 이는 serine의 전기적상태의 환경을 조절하면서 일어난다. 트립신이 촉진시키는 효소반응은 열역학적으로 볼때 유리하지만 엄청난 활성화에너지를 요구로한다. 또한 트립신은 최적pH는 pH8이며, 최적온도는 약 37℃이다.
2.8 시약과 기구
- Equipment
Erlenmeyer Flasks
Beakers
Graduated cylinder
Pipets : 0.02㎖, 0.1㎖, 1㎖
Test tubes
Temperature bath
Thermometer
Balance
Spectrophotometer
Cuvettes
Spectrofluorometer
- Reagent
N,M-Dimethylformamide(DMF) : Sigma 227056, ajhydrous, 99.8%
50 mM Tris-HCl buffer (pH 7.9)
For [E] : Trypsin (TR, Sigma-T0303, CAS 9002-07-7)
For [S] : Nα-Benzoyl-Arg-p-nitroanilide (BP, Sigma-B3133, CAS 21653-40-7)
Figure 2.8 트립신의 분열
3. 실험방법
- 조건 (Condition) : 통상의 실내온도 (약 20℃)
Dilution solution for BP : 99.8% N,M-Dimethylformamide (DMF)
Diluted condition of BP : ..... ㎎/㎖
Dilution solution for TR : 50 mM Tris-HCl buffer (pH 7.9)
Diluted condition of TR : 1 ㎎/㎖
- 방법 (Method) : 410nm에서 분광측광기의 흡광도 측정
- 기구 (Equipment) : Erlenmeyer Flasks
Beakers
Graduated cylinder
Pipets : 0.02㎖, 0.1㎖, 1㎖
Test tubes
Temperature bath
Thermometer
Balance
Spectrophotometer
Cuvettes
Spectrofluorometer
- 시약 (Reagent) : N,M-Dimethylformamide(DMF) : Sigma 227056, ajhydrous, 99.8%
50 mM Tris-HCl buffer (pH 7.9)
For [E] : Trypsin (TR, Sigma-T0303, CAS 9002-07-7)
For [S] : Nα-Benzoyl-Arg-p-nitroanilide (BP, Sigma-B3133, CAS 21653-40-7)
- Protocol Mixing ratio = 980 : 10 : 10 = 50 mM Tris-HCl buffer : BP : TR(1㎎/㎖)
1) Prepare several concentration of BP (diluted as ...㎎/㎖)
2) In cuvettes, input 0.98㎖ 50mM Tris-HCl buffer and 10 ul of BP, mix well
3) Add 10 ul of prepared TR solutions and mix well by prppet and read A410. samples
Nomenclature
k : reaction rate constant, [mol/㎥]1-ns-1
: 볼쯔만 상수()
: Planet 상수(
: 활성화 에너지(J mol-1 or cal mol-1),
R : 절대 기체 상수 (8.314 J mol-1 K-1 or 1.987 cal J mol-1 K-1)
References
1. 생화학, 김명순 외 10인 공저, 형설출판사(2000)
2. 생물학실험, 아카데미서적, 한국생물과학협회(1993)
3. 신판실험생화학, 탐구당, 한국생화학회 교재편찬위원회(1994)
4. Biochemical Engineering Fundamentals, 2nd ed., James E. Bailey, David F. Ollis(1986)
5. Biochemical Calculations, Irwin H. Segel, Wiley(1976)
6. 효소반응속도론, 서정헌, 민음사(1994)
7. 생물화학공학, 아이바 사이치, 동화기술(1988)
8. 생화학계산법, 김창한, 하정욱, 유한문화사(2002)
9. 생물화공개론, 정봉우, 김춘영, 자유아카데미(2005)
10.생물화학공학, 정봉우, 김춘영, 신아출판사(2000)
11.생물반응공학, 山根恒夫, 유한출판사(1979)
12.http://www.foodnara.go.kr/portal/beans/kfdadictionary/jsp/food_word_dic_detail.jsp?field_sq=7746
2.6 pH의 영향
효소는 한정된 범위의 pH에서만 활성이 있으며 이 범위내에서 효소의 안정성이 나타나고 반응속도가 최대로 되는 최적pH(optimum pH)를 가진다. 양극단의 pH에서는 효소의 촉매부위가 파괴되기도 한다. 최적pH에서는 효소 촉매부위의 proton 공여기 및 수용기, 효소-기질 복합체 그리고 기질이 적당한 이온화 상태로 되어 기질과의 친화성이 증가되므로 반응속도가 최대로 된다.
효소는 기질에 따라서 최적 pH가 변화하기도 하며 ATP, NAD+, 아미노산, coenzyme A 등과 같이 기질이 전해질인 경우에는 이들이 일정한 이온형이 아니면 효소는 작용하지 않는다. 세포내에서는 각 부위의 pH가 정확하게 유지되며 그 pH 조절기구는 세포의 대사조절과 밀접한 관계가 있다.
Figure 2.5 무경쟁적 저해(uncompetitive inhibition)
Figure 2.6 반응속도와 시간, 온도와의 관계
Figure 2.7 반응속도의 최적온도
2.7 트립신의 화학적 기능
트립신은 십이지장속으로 들어가서 단백질을 펩티드 또는 아미노산으로 가수분해한다. 이러한 작용은 음식안의 단백질을 섭취하는데 꼭 필요한 작용이다. 드립신은 펩티드 결합의 가수분해를 촉진시킨다. 이러한 효소반응은 다른모든 프로테아제와 비슷하다. 이러한 촉매는 활동하는 영역을 serine nucleophile로 작용시킨다. 이는 serine의 전기적상태의 환경을 조절하면서 일어난다. 트립신이 촉진시키는 효소반응은 열역학적으로 볼때 유리하지만 엄청난 활성화에너지를 요구로한다. 또한 트립신은 최적pH는 pH8이며, 최적온도는 약 37℃이다.
2.8 시약과 기구
- Equipment
Erlenmeyer Flasks
Beakers
Graduated cylinder
Pipets : 0.02㎖, 0.1㎖, 1㎖
Test tubes
Temperature bath
Thermometer
Balance
Spectrophotometer
Cuvettes
Spectrofluorometer
- Reagent
N,M-Dimethylformamide(DMF) : Sigma 227056, ajhydrous, 99.8%
50 mM Tris-HCl buffer (pH 7.9)
For [E] : Trypsin (TR, Sigma-T0303, CAS 9002-07-7)
For [S] : Nα-Benzoyl-Arg-p-nitroanilide (BP, Sigma-B3133, CAS 21653-40-7)
Figure 2.8 트립신의 분열
3. 실험방법
- 조건 (Condition) : 통상의 실내온도 (약 20℃)
Dilution solution for BP : 99.8% N,M-Dimethylformamide (DMF)
Diluted condition of BP : ..... ㎎/㎖
Dilution solution for TR : 50 mM Tris-HCl buffer (pH 7.9)
Diluted condition of TR : 1 ㎎/㎖
- 방법 (Method) : 410nm에서 분광측광기의 흡광도 측정
- 기구 (Equipment) : Erlenmeyer Flasks
Beakers
Graduated cylinder
Pipets : 0.02㎖, 0.1㎖, 1㎖
Test tubes
Temperature bath
Thermometer
Balance
Spectrophotometer
Cuvettes
Spectrofluorometer
- 시약 (Reagent) : N,M-Dimethylformamide(DMF) : Sigma 227056, ajhydrous, 99.8%
50 mM Tris-HCl buffer (pH 7.9)
For [E] : Trypsin (TR, Sigma-T0303, CAS 9002-07-7)
For [S] : Nα-Benzoyl-Arg-p-nitroanilide (BP, Sigma-B3133, CAS 21653-40-7)
- Protocol Mixing ratio = 980 : 10 : 10 = 50 mM Tris-HCl buffer : BP : TR(1㎎/㎖)
1) Prepare several concentration of BP (diluted as ...㎎/㎖)
2) In cuvettes, input 0.98㎖ 50mM Tris-HCl buffer and 10 ul of BP, mix well
3) Add 10 ul of prepared TR solutions and mix well by prppet and read A410. samples
Nomenclature
k : reaction rate constant, [mol/㎥]1-ns-1
: 볼쯔만 상수()
: Planet 상수(
: 활성화 에너지(J mol-1 or cal mol-1),
R : 절대 기체 상수 (8.314 J mol-1 K-1 or 1.987 cal J mol-1 K-1)
References
1. 생화학, 김명순 외 10인 공저, 형설출판사(2000)
2. 생물학실험, 아카데미서적, 한국생물과학협회(1993)
3. 신판실험생화학, 탐구당, 한국생화학회 교재편찬위원회(1994)
4. Biochemical Engineering Fundamentals, 2nd ed., James E. Bailey, David F. Ollis(1986)
5. Biochemical Calculations, Irwin H. Segel, Wiley(1976)
6. 효소반응속도론, 서정헌, 민음사(1994)
7. 생물화학공학, 아이바 사이치, 동화기술(1988)
8. 생화학계산법, 김창한, 하정욱, 유한문화사(2002)
9. 생물화공개론, 정봉우, 김춘영, 자유아카데미(2005)
10.생물화학공학, 정봉우, 김춘영, 신아출판사(2000)
11.생물반응공학, 山根恒夫, 유한출판사(1979)
12.http://www.foodnara.go.kr/portal/beans/kfdadictionary/jsp/food_word_dic_detail.jsp?field_sq=7746






















































소개글