목차
없음
본문내용
4) A(흡광도) VS C(농도)를 그래프에 도시한 후 기울기를 구하여 몰흡광계수(e)를 결정한다.
5) 미지시료의 흡광도를 측정하여 농도를 그래프로부터 읽는다.
<주의>
cell은 항상 같은 방향으로
cell에 손자국을 내지 말것
7. 예비고찰
이번실험은 알려지지 않은 황산구리 용액의 농도를 결정하는 실험이다. 분광광도계를 사용하여 흡광도와 농도 사이의 그래프를 구성하면 Beer-Lambert의 법칙을 따르는 비례관계의 그래프가 구성되는데, 그 그래프를 통해 미지용액의 농도를 확인 할 수 있을 것이라 예상된다. 분광광도계를 사용하며, 그래프를 통해 결과값을 찾아낸다는 점에서, 첫 번째 화학실험의 주제였던 “흡광도 측정”과 매우 흡사한 것 같다. 하지만 이번 실험은 튜브를 5개나 사용하는 더 복잡한 실험이므로, 튜브와 피펫들이 섞이지 않도록 주의해야겠다. 이론적으로 유색의 높은 농도의 용액이 낮은 농도의 용액보다 더 많은 빛을 흡수하게 될 것으로 예상되며, 두 번째 분광광도계의 사용으로 비교적 수월한 실험이 될 것 같다.
8. 참고문헌
일반화학실험 - 일반화학실험 교재연구회, 자유아카데미
화학의 기초 - 팽종인, 박해숙, 신광문화사
컴트렛 - Stephen Thompson, 자유아카데미
물리화학 - 이재원외, 녹문당
1. 실험일자 : 2007. 5. 25 (금)
2. 실험제목 : 용액의 농도결정
3. 실험목적 : 알려지지 않는 황산구리 용액의 농도를 결정한다.
4. 시약 및 기구 : 분광광도계, 0,40M 30ml, 증류수, 비이커 100ml, 피펫, cell, 튜브, 시험관 1~4개
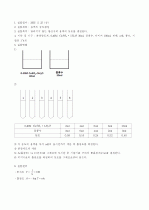
5. 실험방법
1)
2)
0,40M
2ml
4ml
6ml
8ml
10ml
증류수
8ml
6ml
4ml
2ml
0ml
농도
0.08
0.16
0.24
0.32
0.40
3) 각 농도의 용액을 사각 cell의 표시선까지 채운 후 흡광도를 측정한다.
4) 분광계도계 사용
5) A(흡광도) vs C(농도)를 그래프에 도시한 후 기울기를 구하여 몰흡광계수(e)를 결정한다.
6) 미지시료의 흡광도를 측정하여 농도를 그래프로부터 읽는다.
6. 실험원리
투과도
흡광도
Beer-Lambert의 법칙
분광광도계
γ선 x선 UV 가시광선 적외선 마이크로웨이브 NMR
400 800
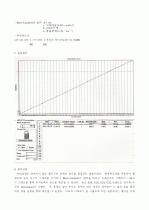
7. 실험결과
8. 결과고찰
이번실험은 알려지지 않은 황산구리 용액의 농도를 결정하는 실험이었다. 분광광도계를 사용하여 흡광도와 농도 사이의 그래프를 구성하니, Beer-Lambert의 법칙을 따르는 비례관계의 그래프가 나왔고 이 그래프를 통해 비지용액의 농도를 확인할 수 있었다. 농도 0.08, 0.16, 0.24, 0.32, 0.40으로 갈수록 큰 수의 Absorbance가 나왔다. 즉, 유색의 높은 온도의 용액은 낮은 농도의 용액보다 더 많은 빛을 흡수하게 됨을 실험을 통해 확인할 수 있었다. 비교적 그래프가 잘 나왔으며 이번 실험에서는 별다른 오차가 없었다. 용액을 넣기 전에 튜브안의 약간의 물방울이 보였지만 그냥 실험을 진행하였는데 다행히 오차가 나오지 않은 것 같다.
5) 미지시료의 흡광도를 측정하여 농도를 그래프로부터 읽는다.
<주의>
cell은 항상 같은 방향으로
cell에 손자국을 내지 말것
7. 예비고찰
이번실험은 알려지지 않은 황산구리 용액의 농도를 결정하는 실험이다. 분광광도계를 사용하여 흡광도와 농도 사이의 그래프를 구성하면 Beer-Lambert의 법칙을 따르는 비례관계의 그래프가 구성되는데, 그 그래프를 통해 미지용액의 농도를 확인 할 수 있을 것이라 예상된다. 분광광도계를 사용하며, 그래프를 통해 결과값을 찾아낸다는 점에서, 첫 번째 화학실험의 주제였던 “흡광도 측정”과 매우 흡사한 것 같다. 하지만 이번 실험은 튜브를 5개나 사용하는 더 복잡한 실험이므로, 튜브와 피펫들이 섞이지 않도록 주의해야겠다. 이론적으로 유색의 높은 농도의 용액이 낮은 농도의 용액보다 더 많은 빛을 흡수하게 될 것으로 예상되며, 두 번째 분광광도계의 사용으로 비교적 수월한 실험이 될 것 같다.
8. 참고문헌
일반화학실험 - 일반화학실험 교재연구회, 자유아카데미
화학의 기초 - 팽종인, 박해숙, 신광문화사
컴트렛 - Stephen Thompson, 자유아카데미
물리화학 - 이재원외, 녹문당
1. 실험일자 : 2007. 5. 25 (금)
2. 실험제목 : 용액의 농도결정
3. 실험목적 : 알려지지 않는 황산구리 용액의 농도를 결정한다.
4. 시약 및 기구 : 분광광도계, 0,40M 30ml, 증류수, 비이커 100ml, 피펫, cell, 튜브, 시험관 1~4개
5. 실험방법
1)
2)
0,40M
2ml
4ml
6ml
8ml
10ml
증류수
8ml
6ml
4ml
2ml
0ml
농도
0.08
0.16
0.24
0.32
0.40
3) 각 농도의 용액을 사각 cell의 표시선까지 채운 후 흡광도를 측정한다.
4) 분광계도계 사용
5) A(흡광도) vs C(농도)를 그래프에 도시한 후 기울기를 구하여 몰흡광계수(e)를 결정한다.
6) 미지시료의 흡광도를 측정하여 농도를 그래프로부터 읽는다.
6. 실험원리
투과도
흡광도
Beer-Lambert의 법칙
분광광도계
γ선 x선 UV 가시광선 적외선 마이크로웨이브 NMR
400 800
7. 실험결과
8. 결과고찰
이번실험은 알려지지 않은 황산구리 용액의 농도를 결정하는 실험이었다. 분광광도계를 사용하여 흡광도와 농도 사이의 그래프를 구성하니, Beer-Lambert의 법칙을 따르는 비례관계의 그래프가 나왔고 이 그래프를 통해 비지용액의 농도를 확인할 수 있었다. 농도 0.08, 0.16, 0.24, 0.32, 0.40으로 갈수록 큰 수의 Absorbance가 나왔다. 즉, 유색의 높은 온도의 용액은 낮은 농도의 용액보다 더 많은 빛을 흡수하게 됨을 실험을 통해 확인할 수 있었다. 비교적 그래프가 잘 나왔으며 이번 실험에서는 별다른 오차가 없었다. 용액을 넣기 전에 튜브안의 약간의 물방울이 보였지만 그냥 실험을 진행하였는데 다행히 오차가 나오지 않은 것 같다.
추천자료
 수소 이온 농도와 지시약 실험
수소 이온 농도와 지시약 실험 pH Titeration(PH 적정)과 완충용액
pH Titeration(PH 적정)과 완충용액 분광학을 이용한 농도분석 결과레포트
분광학을 이용한 농도분석 결과레포트 농도차에따른 흡광도 변화
농도차에따른 흡광도 변화 Preparation and standardization of 0.1N-HCl 0.1 N 염산 표준용액의 조제 및 표준화
Preparation and standardization of 0.1N-HCl 0.1 N 염산 표준용액의 조제 및 표준화 [일반화학실험][예비+결과] 인산의 적정과 완충용액 실험
[일반화학실험][예비+결과] 인산의 적정과 완충용액 실험 일반생물학실험 - 기질농도에 따른 효소의 반응속도
일반생물학실험 - 기질농도에 따른 효소의 반응속도 환경분석화학 - 알칼리도 실험 - 알칼리도 정의, 노르말 농도, EQ농도, 메틸오렌지, 마그네틱...
환경분석화학 - 알칼리도 실험 - 알칼리도 정의, 노르말 농도, EQ농도, 메틸오렌지, 마그네틱... [화학공학 기초 실험] 경도 측정 (EDTA 표준용액으로 적정하고 그 과정의 색 변화를 보고 경...
[화학공학 기초 실험] 경도 측정 (EDTA 표준용액으로 적정하고 그 과정의 색 변화를 보고 경... [식품분석 실험] 산, 염기 표준 용액의 조제 및 표정 법
[식품분석 실험] 산, 염기 표준 용액의 조제 및 표정 법 [화공실험] UV-Visible spectrophotometer을 이용한 미지시료의 정량 분석 결과 : Black 5의 ...
[화공실험] UV-Visible spectrophotometer을 이용한 미지시료의 정량 분석 결과 : Black 5의 ... N/10 과망간산칼륨 표준액의 조제와 표정 : 약 N/10 과망간산칼륨 용액을 조제하여 N/10 옥살...
N/10 과망간산칼륨 표준액의 조제와 표정 : 약 N/10 과망간산칼륨 용액을 조제하여 N/10 옥살... UV SPECTROSCOPY를 이용한 약물농도 측정(결과)
UV SPECTROSCOPY를 이용한 약물농도 측정(결과) 과학 학습 지도안(초등 5학년) - 용액의 성질
과학 학습 지도안(초등 5학년) - 용액의 성질