본문내용
10. 6%,12% 과산화수소 용액 200mL를 이용하여 3~9번과 같은 실험을 반복한다.
Ⅳ.관찰결과 및 논의
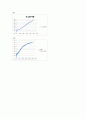
1) 3% 과산화수소의 반응속도
로그로 나타낸 3% 과산화수소의 반응속도
2) 6% 과산화수소의 반응속도
로그로 나타낸 6% 과산화수소의 반응속도
3) 12% 과산화수소의 반응속도
로그로 나타낸 12% 과산화수소의 반응속도
Ⅴ. 결 론
우리는 P(압력)*V(부피) = n(기체량)*R(기체상수)*T(온도) 임을 알고 있다.
실험에서 부피와 온도는 일정했고, 기체상수 역시 상수값이므로 측정한 압력의 증가는 실제 압력의 증가나 기체량의 증가에 의한 것임을 예측할 수 있다.
과산화수소의 경우 2HO -> 2HO + O 의 반응식으로 반응을 하고 2몰의 과산화수소가 2몰의 물과 1몰의 산소로 분해되므로 결국 기체량인 n의 변화에 의한 압력의 변화라 생각할 수 있다.
우리가 이번 실험에서 측정한 값은 산소 분압의 증가량과 전체 기체의 압력의 증가량이다. 우선 산소분압은 기존 산소의 분압+산소증가에 의한 분압+기체 압력 증가에 따른 분압 으로 표현할 수 있다. 때문에 우리가 이번에 측정한 산소분압의 증가량은 기존 산소의 분압만을 제외한 값이 되는 것이다. 따라서 정확한 산소증가량을 구하기 위해서는 기체 압력 증가에 따른 산소 분압의 증가량을 제거해 주어야한다. 하지만 기체 압력 증가에 의한 부차적인 증가량을 구하는 방법이 어려워 하지 못했다. 그 외에 산소분압의 경우 실제 산소증가량과 기체압력의 증가량의 곱으로 표현될 수 있고 측정한 값의 식은 산소분압과 기체압력을 알고 있으므로 이를 통해 산소증가량을 유추할 수 있다.
함수
산소분압
기체압력증가량
산소증가량
3%
과산화수소
y = 2E-06x2 + 0.001x + 20.933
y = -2E-05x2 + 0.0297x + 3.4534
2E-06x2 + 0.001x
/
2E-05x2 + 0.0297x
6%
과산화수소
y = 3E-06x2 + 0.0011x + 20.784
y = -3E-05x2 + 0.0394x + 6.0487
3E-06x2 + 0.0011x
/
-3E-05x2 + 0.0394x
12%
과산화수소
y = 2E-06x2 + 0.0035x + 20.618
y = -9E-06x2 + 0.0544x + 1.6003
2E-06x2 + 0.0035x
/
-9E-06x2 + 0.0544x
산소증가량을 엑셀로 풀어보면 아래와 같다
-3%
-6%
-12%
Ⅳ.관찰결과 및 논의
1) 3% 과산화수소의 반응속도
로그로 나타낸 3% 과산화수소의 반응속도
2) 6% 과산화수소의 반응속도
로그로 나타낸 6% 과산화수소의 반응속도
3) 12% 과산화수소의 반응속도
로그로 나타낸 12% 과산화수소의 반응속도
Ⅴ. 결 론
우리는 P(압력)*V(부피) = n(기체량)*R(기체상수)*T(온도) 임을 알고 있다.
실험에서 부피와 온도는 일정했고, 기체상수 역시 상수값이므로 측정한 압력의 증가는 실제 압력의 증가나 기체량의 증가에 의한 것임을 예측할 수 있다.
과산화수소의 경우 2HO -> 2HO + O 의 반응식으로 반응을 하고 2몰의 과산화수소가 2몰의 물과 1몰의 산소로 분해되므로 결국 기체량인 n의 변화에 의한 압력의 변화라 생각할 수 있다.
우리가 이번 실험에서 측정한 값은 산소 분압의 증가량과 전체 기체의 압력의 증가량이다. 우선 산소분압은 기존 산소의 분압+산소증가에 의한 분압+기체 압력 증가에 따른 분압 으로 표현할 수 있다. 때문에 우리가 이번에 측정한 산소분압의 증가량은 기존 산소의 분압만을 제외한 값이 되는 것이다. 따라서 정확한 산소증가량을 구하기 위해서는 기체 압력 증가에 따른 산소 분압의 증가량을 제거해 주어야한다. 하지만 기체 압력 증가에 의한 부차적인 증가량을 구하는 방법이 어려워 하지 못했다. 그 외에 산소분압의 경우 실제 산소증가량과 기체압력의 증가량의 곱으로 표현될 수 있고 측정한 값의 식은 산소분압과 기체압력을 알고 있으므로 이를 통해 산소증가량을 유추할 수 있다.
함수
산소분압
기체압력증가량
산소증가량
3%
과산화수소
y = 2E-06x2 + 0.001x + 20.933
y = -2E-05x2 + 0.0297x + 3.4534
2E-06x2 + 0.001x
/
2E-05x2 + 0.0297x
6%
과산화수소
y = 3E-06x2 + 0.0011x + 20.784
y = -3E-05x2 + 0.0394x + 6.0487
3E-06x2 + 0.0011x
/
-3E-05x2 + 0.0394x
12%
과산화수소
y = 2E-06x2 + 0.0035x + 20.618
y = -9E-06x2 + 0.0544x + 1.6003
2E-06x2 + 0.0035x
/
-9E-06x2 + 0.0544x
산소증가량을 엑셀로 풀어보면 아래와 같다
-3%
-6%
-12%



























소개글