목차
1. 실험제목
2. 실험날짜
3. 실험목적
4. 실험이론
4-1. 평형상수의 결정
4-2. 용해도곱상수의 결정
5. 실험기구 및 시약
5-1. 실험기구
5-2. 시약
6. 실험방법
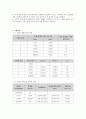
7. 실험결과
8. 고찰
8-1. 오차의 원인 분석
8-2. 오차를 줄이기 위한 방안
8-3. 생각해야 할 사항
9. 참고문헌 및 사이트
2. 실험날짜
3. 실험목적
4. 실험이론
4-1. 평형상수의 결정
4-2. 용해도곱상수의 결정
5. 실험기구 및 시약
5-1. 실험기구
5-2. 시약
6. 실험방법
7. 실험결과
8. 고찰
8-1. 오차의 원인 분석
8-2. 오차를 줄이기 위한 방안
8-3. 생각해야 할 사항
9. 참고문헌 및 사이트
본문내용
않아야 한다.
하지만 Ca(OH)2가 포함되었을 수 있다.
2) 육안으로 적정점을 찾기 힘들다.
아무래도 육안으로 관찰하는 것이기 때문에 미세한 색깔의 변화를 찾아내기가 힘들다.
그래서 적정점을 넘어서서 적정량을 초과하여 넣었을 것이다.
3) Ca(OH)2을 덜 녹였을 수 있다.
Ca(OH)2을 완전히 녹이고 실험하여야 하지만 Ca(OH)2을 완전히 녹이기 힘들었다.
그래서 평형점에 도달하지 않았을 것이다.
4) 온도의 변화를 감지하기가 힘들었다.
다른 M농도의 용액을 썼을 때 온도의 변화는 분명 있었다. 하지만 변화량이 너무 미세해서 보통 온도계로는 측정하기가 불가능했다.
5) 페놀프탈레인의 온도가 실험결과에 영향을 주었을 것이다.
페놀프탈레인을 2~3방울 정도로 조금 넣어주어야 하지만 실수로 많이 넣어서 페놀프탈레인의 온도가 실험결과에 영향을 주었을 것이다.
8-2. 오차를 줄이기 위한 방안
1) Ca(OH)2를 충분히 녹인다.
충분히 녹이기 위해선 10분정도 계속 저어주어야 한다.
2) 전자온도계를 사용한다.
좀더 정확한 온도를 측정하기 위해선 시중에서 쓰이고 있는 수온온도계보다는 소수점까지 측정되는 전자온도계를 사용하는 것이 정확하고 편리하다.
3) 페놀프탈레인을 2~3방울만 넣도록 한다.
페놀프탈레인은 지시약이므로 조금의 양만 필요할 뿐이다.
4) 실험에 집중하여 좀더 정확한 적정점을 찾도록 한다.
이번 실험의 중요한 것은 적정점을 만들기 위해 사용되는 HCl의 적정량이므로 용액의 색 변화를 유심히 관찰하도록 한다.
8-3. 생각해야 할 사항
1) 수산화나트륨과 수산화칼슘의 혼합용액에서 수산화이온이 증가하면 칼슘이온이 수산화칼륨으로 석출되는데, 이온화경향으로 따지면 나트륨이 칼슘보다 이온화경향이 한 단계 낮다. 그런데 나트륨이 석출되는 것이 아니고 칼슘이온이 석출되는 이유는 무엇인가?
→ 금속의 반응성과는 관련이 없다. 수산화칼슘은 고체이고, 수산화나트륨은 염기로 용해가 잘 되는 물질이다. 이온화경향과는 서로 관련이 없는 것이다. 여기서 수산화칼륨의 앙금으로 생성되는 것은 용해도가 낮기 때문이다.
9. 참고문헌 및 사이트
1) 일반화학실험(청문사,2003) - 조성일, 이도원
2) 두산동아백과사전
3) http://kr.encycl.yahoo.com
4) http://www.dongseo.ac.kr/appli_home/study/index.htm
5) 위키피디아(www.wikipedia.org)
하지만 Ca(OH)2가 포함되었을 수 있다.
2) 육안으로 적정점을 찾기 힘들다.
아무래도 육안으로 관찰하는 것이기 때문에 미세한 색깔의 변화를 찾아내기가 힘들다.
그래서 적정점을 넘어서서 적정량을 초과하여 넣었을 것이다.
3) Ca(OH)2을 덜 녹였을 수 있다.
Ca(OH)2을 완전히 녹이고 실험하여야 하지만 Ca(OH)2을 완전히 녹이기 힘들었다.
그래서 평형점에 도달하지 않았을 것이다.
4) 온도의 변화를 감지하기가 힘들었다.
다른 M농도의 용액을 썼을 때 온도의 변화는 분명 있었다. 하지만 변화량이 너무 미세해서 보통 온도계로는 측정하기가 불가능했다.
5) 페놀프탈레인의 온도가 실험결과에 영향을 주었을 것이다.
페놀프탈레인을 2~3방울 정도로 조금 넣어주어야 하지만 실수로 많이 넣어서 페놀프탈레인의 온도가 실험결과에 영향을 주었을 것이다.
8-2. 오차를 줄이기 위한 방안
1) Ca(OH)2를 충분히 녹인다.
충분히 녹이기 위해선 10분정도 계속 저어주어야 한다.
2) 전자온도계를 사용한다.
좀더 정확한 온도를 측정하기 위해선 시중에서 쓰이고 있는 수온온도계보다는 소수점까지 측정되는 전자온도계를 사용하는 것이 정확하고 편리하다.
3) 페놀프탈레인을 2~3방울만 넣도록 한다.
페놀프탈레인은 지시약이므로 조금의 양만 필요할 뿐이다.
4) 실험에 집중하여 좀더 정확한 적정점을 찾도록 한다.
이번 실험의 중요한 것은 적정점을 만들기 위해 사용되는 HCl의 적정량이므로 용액의 색 변화를 유심히 관찰하도록 한다.
8-3. 생각해야 할 사항
1) 수산화나트륨과 수산화칼슘의 혼합용액에서 수산화이온이 증가하면 칼슘이온이 수산화칼륨으로 석출되는데, 이온화경향으로 따지면 나트륨이 칼슘보다 이온화경향이 한 단계 낮다. 그런데 나트륨이 석출되는 것이 아니고 칼슘이온이 석출되는 이유는 무엇인가?
→ 금속의 반응성과는 관련이 없다. 수산화칼슘은 고체이고, 수산화나트륨은 염기로 용해가 잘 되는 물질이다. 이온화경향과는 서로 관련이 없는 것이다. 여기서 수산화칼륨의 앙금으로 생성되는 것은 용해도가 낮기 때문이다.
9. 참고문헌 및 사이트
1) 일반화학실험(청문사,2003) - 조성일, 이도원
2) 두산동아백과사전
3) http://kr.encycl.yahoo.com
4) http://www.dongseo.ac.kr/appli_home/study/index.htm
5) 위키피디아(www.wikipedia.org)



























소개글