본문내용
” p164 궁리(2008)
참고 4 : Raymond Chang “일반화학“ 8th ed. p664 자유아카데미(2006)
6. 연습문제
가. 초산 용액 25mL를 피펫으로 250mL 삼각 플라스크에 옮기고, 증류수 100mL를 넣어 주었다. 이 요액에 0.1N 수산화나트륨용액을 가하면서 pH를 측정하였다.
염기량
0
2.02
4.08
6.98
9.22
10.04
11.12
12.04
13.08
14.10
14.56
15.02
pH
4.35
4.75
5.05
5.30
5.65
5.85
5.95
6.10
6.25
6.60
6.75
7.15
염기량
15.52
15.60
15.80
15.92
16.14
16.48
16.92
17.50
18.62
19.20
20.04
pH
7.60
8.35
10.05
10.70
11.05
11.45
11.70
12.05
12.25
12.40
12.44
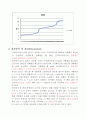
1) 전위차 적정곡선을 그리고 당량점을 결정하라.
초산에서 pH가 갑자기 상승한 구간은 수산화나트륨 15.52mL를 가해줬을 때 pH인 7.60부터 15.92mL를 가해줬을 때 pH인 10.70까지이므로 당량점은 (7.60+10.70)/2 = 9.15이다.
2) 초산 용액의 농도를 결정하라.
초산에서 당량점인 9.15에 도달하기 위해 가해준 염기량은 약 15.7mL이므로 Cs = Ca의 조건이 성립되는 염기량은 7.85mL, 이 때의 pH는 약 5.45이고 pKa도 5.45가 된다. pKa = -logKa의 공식을 이용하면 Ka는 3.55*10-6가 되고 이 때에는 Ka = [H+]이므로 수소이온의 농도 역시 3.55*10-6가 된다.
0.1N의 수산화나트륨을 당량점인 9.15까지 약 15.7mL 사용하였고 실험에 사용된 초산은 125mL이므로 초산은 0.0125N가 된다.
나. 0.05M 인산 용액을 0.10N 수산화나트륨 용액으로 적정할 때 두 개의 변곡점이 얻어진다. 이를 염산의 경우와 비교하여 설명하라.
인산은 중화될 수 있는 부분이 2개라는 뜻이다. 수소 이온이 2개 이상인 산을 염기로 적정을 하면 첫 번째 수소이온이 중화되는데 거의 pH의 변화는 적고 알칼리는 상당량이 투입된다. 그 후 pH가 다시 올라가고 다시 변화가 적으면서 알칼리가 소모된다. 결국 두 개의 수소이온이 다 중화되는데 그 pH가 달라서 곡선이 두 번 꺾이는 현상이 생기는 것이다. 하지만 염사는 수소 이온이 한 개 이므로 한 개의 변곡점 만을 가진다.
참고 4 : Raymond Chang “일반화학“ 8th ed. p664 자유아카데미(2006)
6. 연습문제
가. 초산 용액 25mL를 피펫으로 250mL 삼각 플라스크에 옮기고, 증류수 100mL를 넣어 주었다. 이 요액에 0.1N 수산화나트륨용액을 가하면서 pH를 측정하였다.
염기량
0
2.02
4.08
6.98
9.22
10.04
11.12
12.04
13.08
14.10
14.56
15.02
pH
4.35
4.75
5.05
5.30
5.65
5.85
5.95
6.10
6.25
6.60
6.75
7.15
염기량
15.52
15.60
15.80
15.92
16.14
16.48
16.92
17.50
18.62
19.20
20.04
pH
7.60
8.35
10.05
10.70
11.05
11.45
11.70
12.05
12.25
12.40
12.44
1) 전위차 적정곡선을 그리고 당량점을 결정하라.
초산에서 pH가 갑자기 상승한 구간은 수산화나트륨 15.52mL를 가해줬을 때 pH인 7.60부터 15.92mL를 가해줬을 때 pH인 10.70까지이므로 당량점은 (7.60+10.70)/2 = 9.15이다.
2) 초산 용액의 농도를 결정하라.
초산에서 당량점인 9.15에 도달하기 위해 가해준 염기량은 약 15.7mL이므로 Cs = Ca의 조건이 성립되는 염기량은 7.85mL, 이 때의 pH는 약 5.45이고 pKa도 5.45가 된다. pKa = -logKa의 공식을 이용하면 Ka는 3.55*10-6가 되고 이 때에는 Ka = [H+]이므로 수소이온의 농도 역시 3.55*10-6가 된다.
0.1N의 수산화나트륨을 당량점인 9.15까지 약 15.7mL 사용하였고 실험에 사용된 초산은 125mL이므로 초산은 0.0125N가 된다.
나. 0.05M 인산 용액을 0.10N 수산화나트륨 용액으로 적정할 때 두 개의 변곡점이 얻어진다. 이를 염산의 경우와 비교하여 설명하라.
인산은 중화될 수 있는 부분이 2개라는 뜻이다. 수소 이온이 2개 이상인 산을 염기로 적정을 하면 첫 번째 수소이온이 중화되는데 거의 pH의 변화는 적고 알칼리는 상당량이 투입된다. 그 후 pH가 다시 올라가고 다시 변화가 적으면서 알칼리가 소모된다. 결국 두 개의 수소이온이 다 중화되는데 그 pH가 달라서 곡선이 두 번 꺾이는 현상이 생기는 것이다. 하지만 염사는 수소 이온이 한 개 이므로 한 개의 변곡점 만을 가진다.



























소개글