목차
[ LIST OF CONTENTS ]
LIST OF CONTENTS
LIST OF TABLES
LIST OF FIGURES
1. ABSTRACT
2. INTRODUCTION
2.1 실험목적
2.2 실험이론
2.3 실험주의사항
2.4 시약의 특성
3. EXPERIMENTAL
3.1 기구 및 시약
3.2 실험절차
4. RESULTS
4.1 Raw data
4.2 Results
5. DISCUSSION
6. REFERENCE
LIST OF CONTENTS
LIST OF TABLES
LIST OF FIGURES
1. ABSTRACT
2. INTRODUCTION
2.1 실험목적
2.2 실험이론
2.3 실험주의사항
2.4 시약의 특성
3. EXPERIMENTAL
3.1 기구 및 시약
3.2 실험절차
4. RESULTS
4.1 Raw data
4.2 Results
5. DISCUSSION
6. REFERENCE
본문내용
있다.
임의의 화학반응에 대한 반응 Gibbs 에너지는 다음과 같다.
G=G+RTlnQ
여기서 Q는 활동도의 비이다. 이 식은 또 다음과 같이 적을 수 있다.
-nF=G+RTlnQ
전지의 표준전위에서 활동도의 비가 1이라고 하면
G=-nF (2)
이다.
2.3 실험주의사랑
한천과 질산칼륨으로 염다리를 만들 때 적당한 비율로 섞는다.
전지전압이 일정할 때 전압을 읽는다.
전지가 비교적 빨리 소모되므로 전압측정은 만든 후 2~3시간 안에 끝내야 한다.
2.4 시약의 특성
2.4.1 황산구리
구리의 황산염으로 1가의 황산구리(Ⅰ)및 2가의 황산구리(Ⅱ)가 있다.
황산구리(Ⅱ):CuSO4 푸른색의 투명한 결정으로 비중은 2.286이다.
2.4.2 황산아연
ZnSO4. 무수염은 무색의 분말로 비중 3.474이다. 물에 잘 녹고 100g의 물에 대하여 0℃에 42g, 100℃에서 61g 용해한다.
Table 1. 실험물리상수
원소
원소기호
원자번호
원자량
녹는점(℃)
끓는점(℃)
비중(20℃)
아연
Zn
30
65.39
419.6
907
7.14
구리
Cu
29
63.546
1084.5
2595
8.92
3. EXPERIMENTAL
3.1 기구 및 시약
기구 : U자관, 비커, 100ml 부피플라스크, 유리막대, 전선, 전압계, 솜, 가열기구,
시약 : 한천, 질산칼륨, 증류수, 황산구리, 황산아연, 아연판, 구리판
전압계
염다리
CuSO4
ZnSO4
Figure 1. 다니엘 전지
3.2 실험절차
400ml비커에 물 200ml를 넣고 한천과 질산칼륨을 조금씩 적당량 넣으면서 다 녹을 때까지 가열하면서 저어준 후 이 용액을 U자관에 넣어 식혔다. 그 다음 황산구리와 황산아연 용액을 만들었다. 황산구리의 경우 100ml 부피플라스크에 증류수를 적당량 넣은 후 1몰은 황산구리 고체 24.968g, 2몰은 49.936g을 넣고 녹인 다음 증류수를 플라스크 표시선까지 넣었다. 황산아연의 경우도 마찬가지로 100ml 부피플라스크에 증류수를 적당량 넣은 후 1몰은 황산아연 고체 28.754g, 2몰은 57.508g을 넣고 녹인 다음 증류수를 플라스크 표시선까지 넣었다. 황산구리, 황산 아연용액을 두 비커에 담고 준비해 둔 염다리에 솜을 넣은 후 두 용액에 넣어 연결했다. 그리고 전선이 각각 연결된 구리판과 아연판을 각각 구리용액과 아연용액에 담그고 전극을 연결했다. 1몰과 2몰에 따른 기전력을 측정한 다음 염다리 하나일 때와 2개일 때의 기전력도 측정하였다.
4. RESULTS
4.1 Raw data
Table 2. Raw data
염다리(개)
1M(V)
2M(V)
이론값(V)
1
1.5
1.7
1.1
2
1.5
1.7
1.1
4.2 Result
이다.
이며 같은 방법으로 나머지 경우도 계산한다.
Table 3. G(자유에너지변화)
용액의 농도(염다리 수)
자유에너지 변화(G)
실험값(J)
이론값(J)
1M(1)
-2.89×105
-2.12×105
1M(2)
-2.89×105
-2.12×105
2M(1)
-3.28×105
-2.12×105
2M(2)
-3.28×105
-2.12×105
Table 4. 오차율
용액의 농도(염다리 수)
기전력 오차율(%)
자유에너지변화 오차율(%)
1M(1)
36.36
36.32
1M(2)
36.36
36.32
2M(1)
54.54
54.71
2M(2)
54.54
54.71
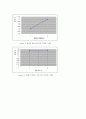
Figure 2. 용액의 몰농도에 따른 기전력 그래프
Figure 3. 2M에서 염다리 수에 따른 기전력 그래프
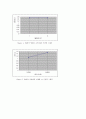
Figure 4. 1M에서 염다리 수에 따른 기전력 그래프
Figure 5. 1M에서 이론값과 실제값 vs 기전력 그래프
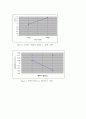
Figure 6. 2M에서 이론값과 실제값 vs 기전력 그래프
Figure 7. 용액의 몰농도 vs 자유에너지 그래프
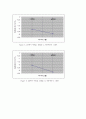
Figure 8. 1M에서 이론값, 실험값 vs 자유에너지 그래프
Figure 9. 2M에서 이론값, 실험값 vs 자유에너지 그래프
5. DISCUSSION
실험 결과 용액 1몰의 기전력은 1.5V, 2몰의 기전력은 1.7V이며 염다리의 개수에 따른 변화는 없었다. 실험 결과 얻은 데이터로부터 구한 자유에너지는 1몰 -2.89×105, 2몰 -3.28×105이다. 오차율은 기전력의 경우 1몰 36.36%, 2몰 54.54%이고 자유에너지의 경우에는 1몰 36.32%, 2몰 54.71% 이었다.
오차의 원인에는 용액의 농도가 있다. 황산구리 2몰의 경우 고체가 잘 녹지 않았기 때문에 황산아연과 농도가 달라서 기전력 값에 오차가 생겼다. Nernst 식에 따르면 기전력은 두 용액의 농도 차에 따라서 달라진다. 따라서 두 용액의 농도차가 같지 않게 되면 오차가 발생하는 것이다. 이번 실험에서 이 부분이 제일 중요하였는데 몰농도를 고체의 용해도 범위 안에서 정하여 측정하는 것이 오차를 줄이는 방법이다.
또 적게는 염다리의 영향도 있다. 이번 실험에서 중요한 것은 염다리인데 염다리를 적절히 만들지 않으면 오차가 생기게 된다. 염다리는 전지의 전하균형을 위해 필요하기 때문에 중요하다.
이번 실험에서 기전력은 염다리의 개수와 무관하였는데 그 이유는 염다리 하나로도 두 용액의 전하균형이 충분히 이루어지기 때문인 것 같다. 하지만 몰농도에 따라 기전력 값은 달라졌다. 원래는 황산구리와 황산아연의 몰농도가 같으면 농도에 변화를 주어도 기전력 값은 변화하지 않는다. 2몰의 황산구리 고체가 충분히 녹지 않아 이러한 결과가 생겼는데 만일 두 용액의 농도가 같다면 기전력 값은 같을 것이다.
기전력 값으로부터 자유에너지를 구해보았는데 예상대로 음의 값을 가졌다. 기전력 값이 0보다 크면 자발적 반응이기 때문이다. 자유에너지는 자발적인 반응에서 양의 값을 가진다. 자유에너지 값을 구해보면서 기전력과 자유에너와의 관계를 알 수 있었고, 왜 기전력 값이 0보다 크면 자발적 반응인지도 알 수 있었다.
본 실험의 데이터에 큰 오차가 발생하였는데 오차의 원인에 대해 생각해보고 다니엘 전지에 대해 좀 더 알아보는 기회가 되었다.
6. REFERENCE
1. H.S.Shin. "Fundamental Chemical Engineering Laboratory Manual"
임의의 화학반응에 대한 반응 Gibbs 에너지는 다음과 같다.
G=G+RTlnQ
여기서 Q는 활동도의 비이다. 이 식은 또 다음과 같이 적을 수 있다.
-nF=G+RTlnQ
전지의 표준전위에서 활동도의 비가 1이라고 하면
G=-nF (2)
이다.
2.3 실험주의사랑
한천과 질산칼륨으로 염다리를 만들 때 적당한 비율로 섞는다.
전지전압이 일정할 때 전압을 읽는다.
전지가 비교적 빨리 소모되므로 전압측정은 만든 후 2~3시간 안에 끝내야 한다.
2.4 시약의 특성
2.4.1 황산구리
구리의 황산염으로 1가의 황산구리(Ⅰ)및 2가의 황산구리(Ⅱ)가 있다.
황산구리(Ⅱ):CuSO4 푸른색의 투명한 결정으로 비중은 2.286이다.
2.4.2 황산아연
ZnSO4. 무수염은 무색의 분말로 비중 3.474이다. 물에 잘 녹고 100g의 물에 대하여 0℃에 42g, 100℃에서 61g 용해한다.
Table 1. 실험물리상수
원소
원소기호
원자번호
원자량
녹는점(℃)
끓는점(℃)
비중(20℃)
아연
Zn
30
65.39
419.6
907
7.14
구리
Cu
29
63.546
1084.5
2595
8.92
3. EXPERIMENTAL
3.1 기구 및 시약
기구 : U자관, 비커, 100ml 부피플라스크, 유리막대, 전선, 전압계, 솜, 가열기구,
시약 : 한천, 질산칼륨, 증류수, 황산구리, 황산아연, 아연판, 구리판
전압계
염다리
CuSO4
ZnSO4
Figure 1. 다니엘 전지
3.2 실험절차
400ml비커에 물 200ml를 넣고 한천과 질산칼륨을 조금씩 적당량 넣으면서 다 녹을 때까지 가열하면서 저어준 후 이 용액을 U자관에 넣어 식혔다. 그 다음 황산구리와 황산아연 용액을 만들었다. 황산구리의 경우 100ml 부피플라스크에 증류수를 적당량 넣은 후 1몰은 황산구리 고체 24.968g, 2몰은 49.936g을 넣고 녹인 다음 증류수를 플라스크 표시선까지 넣었다. 황산아연의 경우도 마찬가지로 100ml 부피플라스크에 증류수를 적당량 넣은 후 1몰은 황산아연 고체 28.754g, 2몰은 57.508g을 넣고 녹인 다음 증류수를 플라스크 표시선까지 넣었다. 황산구리, 황산 아연용액을 두 비커에 담고 준비해 둔 염다리에 솜을 넣은 후 두 용액에 넣어 연결했다. 그리고 전선이 각각 연결된 구리판과 아연판을 각각 구리용액과 아연용액에 담그고 전극을 연결했다. 1몰과 2몰에 따른 기전력을 측정한 다음 염다리 하나일 때와 2개일 때의 기전력도 측정하였다.
4. RESULTS
4.1 Raw data
Table 2. Raw data
염다리(개)
1M(V)
2M(V)
이론값(V)
1
1.5
1.7
1.1
2
1.5
1.7
1.1
4.2 Result
이다.
이며 같은 방법으로 나머지 경우도 계산한다.
Table 3. G(자유에너지변화)
용액의 농도(염다리 수)
자유에너지 변화(G)
실험값(J)
이론값(J)
1M(1)
-2.89×105
-2.12×105
1M(2)
-2.89×105
-2.12×105
2M(1)
-3.28×105
-2.12×105
2M(2)
-3.28×105
-2.12×105
Table 4. 오차율
용액의 농도(염다리 수)
기전력 오차율(%)
자유에너지변화 오차율(%)
1M(1)
36.36
36.32
1M(2)
36.36
36.32
2M(1)
54.54
54.71
2M(2)
54.54
54.71
Figure 2. 용액의 몰농도에 따른 기전력 그래프
Figure 3. 2M에서 염다리 수에 따른 기전력 그래프
Figure 4. 1M에서 염다리 수에 따른 기전력 그래프
Figure 5. 1M에서 이론값과 실제값 vs 기전력 그래프
Figure 6. 2M에서 이론값과 실제값 vs 기전력 그래프
Figure 7. 용액의 몰농도 vs 자유에너지 그래프
Figure 8. 1M에서 이론값, 실험값 vs 자유에너지 그래프
Figure 9. 2M에서 이론값, 실험값 vs 자유에너지 그래프
5. DISCUSSION
실험 결과 용액 1몰의 기전력은 1.5V, 2몰의 기전력은 1.7V이며 염다리의 개수에 따른 변화는 없었다. 실험 결과 얻은 데이터로부터 구한 자유에너지는 1몰 -2.89×105, 2몰 -3.28×105이다. 오차율은 기전력의 경우 1몰 36.36%, 2몰 54.54%이고 자유에너지의 경우에는 1몰 36.32%, 2몰 54.71% 이었다.
오차의 원인에는 용액의 농도가 있다. 황산구리 2몰의 경우 고체가 잘 녹지 않았기 때문에 황산아연과 농도가 달라서 기전력 값에 오차가 생겼다. Nernst 식에 따르면 기전력은 두 용액의 농도 차에 따라서 달라진다. 따라서 두 용액의 농도차가 같지 않게 되면 오차가 발생하는 것이다. 이번 실험에서 이 부분이 제일 중요하였는데 몰농도를 고체의 용해도 범위 안에서 정하여 측정하는 것이 오차를 줄이는 방법이다.
또 적게는 염다리의 영향도 있다. 이번 실험에서 중요한 것은 염다리인데 염다리를 적절히 만들지 않으면 오차가 생기게 된다. 염다리는 전지의 전하균형을 위해 필요하기 때문에 중요하다.
이번 실험에서 기전력은 염다리의 개수와 무관하였는데 그 이유는 염다리 하나로도 두 용액의 전하균형이 충분히 이루어지기 때문인 것 같다. 하지만 몰농도에 따라 기전력 값은 달라졌다. 원래는 황산구리와 황산아연의 몰농도가 같으면 농도에 변화를 주어도 기전력 값은 변화하지 않는다. 2몰의 황산구리 고체가 충분히 녹지 않아 이러한 결과가 생겼는데 만일 두 용액의 농도가 같다면 기전력 값은 같을 것이다.
기전력 값으로부터 자유에너지를 구해보았는데 예상대로 음의 값을 가졌다. 기전력 값이 0보다 크면 자발적 반응이기 때문이다. 자유에너지는 자발적인 반응에서 양의 값을 가진다. 자유에너지 값을 구해보면서 기전력과 자유에너와의 관계를 알 수 있었고, 왜 기전력 값이 0보다 크면 자발적 반응인지도 알 수 있었다.
본 실험의 데이터에 큰 오차가 발생하였는데 오차의 원인에 대해 생각해보고 다니엘 전지에 대해 좀 더 알아보는 기회가 되었다.
6. REFERENCE
1. H.S.Shin. "Fundamental Chemical Engineering Laboratory Manual"


































소개글