목차
1. Introduction
2. Experimental
3. Result & Discussion
2. Experimental
3. Result & Discussion
본문내용
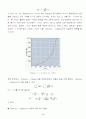
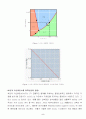
{ 760mmHg} over {580mmHg } = { △Hv} over {2.303R } (0.002715-0.002692)
△Hv = 97.732 KJ/mol
증류수의 평균증발열 △Hv = 78.940 KJ/mol(실험치)
증류수의 증발열 △Hv = 40.70 KJ/mol(이론치)
△Hv = 97.732 KJ/mol
증류수의 평균증발열 △Hv = 78.940 KJ/mol(실험치)
증류수의 증발열 △Hv = 40.70 KJ/mol(이론치)








































소개글