목차
1. ABSTRACT
2. INTRODUCTION
2.1 실험목적
2.2 실험이론
2.3 실험주의사항
2.4 시약의 특성
3. EXPERIMENTAL
3.1 기구 및 시약
3.2 실험절차
4. RESULTS
4.1 Raw data
4.2 Results
5. DISCUSSION
6. REFERENCE
2. INTRODUCTION
2.1 실험목적
2.2 실험이론
2.3 실험주의사항
2.4 시약의 특성
3. EXPERIMENTAL
3.1 기구 및 시약
3.2 실험절차
4. RESULTS
4.1 Raw data
4.2 Results
5. DISCUSSION
6. REFERENCE
본문내용
을 진행시키기 위해 주위로부터 열을 흡수해야 한다. 온도를 높여주면 용질과 용매 주변에 충분한 열이 존재하게 되어 주변으로부터 열을 흡수하기가 쉽다. 따라서 용해가 더 잘 일어난다. 반대로 온도를 낮춰주면 주위로부터 열을 흡수하기가 어려워 용해가 잘 일어나지 않는다. 그래서, 용해 과정이 흡열 반응인 경우, 온도를 높일수록 용해도가 증가하는, \"기울기>0\"인 용해도 곡선이 그려진다.
용해 과정이 발열 반응인 경우에도 그 원리는 흡열 반응의 경우와 같으며 반대의 결과를 나타낸다. 즉 온도를 높여주면 용해도가 감소하고 온도를 낮춰주면 용해도가 증가한다. 따라서 \"기울기<0(음)\"인 용해도 곡선이 그려진다.
용
해
도
NaNO3
KNO3
온 도
KCl
NaCl
Ce2(SO4)3
용해도 곡선 상의 모든 점은 그 온도에서의 포화용액을 나타내며 곡선 위의 점은 과포화 용액을, 곡선 아래의 점은 불포화용액을 나타낸다.
2.2.3 용해도 결정
포화용액에 대해서, 그 용매 100g 중의 용질의 수를 그람용해도(solubility)라 한다. 용해도는 온도에 따라서 다르고, 그 관계도가 용해도 곡선이다. 이 실험에서는 여러 가지 고체의 물에 대한 용해도를 여러 온도에서 측정하고 용해도 곡선을 그린다.
온도 t에 대해서의 용해도를 s, 그 때의 용해열 (계가 외계에서 열을 흡수했을 때, 즉 흡열을 양(+)으로 한다)가 온도에 의해서 변하지 않는다고 하면, van\'t Hoff의 이론에서
(1)
여기에서 R는 기체상수, C는 적분상수이다.
온도 T1, T2에 있어서의 용해도를 S1, S2라 하면 식 (1)에서
(2)
두 온도에 있어서의 용해도를 측정하면 이 식에서 용해열 가 계산으로 구해진다.
2.3 실험 주의사항
실온에서 고체를 거른다.
증발접시의 무게를 잴 때는 수분을 완전히 제거한다.
2.4 시약의 특성
안식향산(C6H5COOH)
물에 대한 용해도는 25℃에서 3.4g/L 이고, 뜨거운 물에서는 매우 잘 녹는다.
Table 1. 실험물리상수
시료
분자식
녹는점(℃)
끓는점(℃)
밀도(g/cm3)
용해도(g/L)
안식향산
C6H5COOH
122.4
24.9
1.32
3.4(25℃)
3. EXPERIMENTAL
3.1 기구 및 시약
기구 : 비커, 증발접시, 유리막대, 온도계, 항온조, pipette, 건조기
시약 : 증류수, 안식향산
3.2 실험절차
우선 실험에 필요한 기구와 시약을 준비하였다. 그 다음 증발 접시의 무게를 재었다. 실온에서 비커에 적당량의 증류수와 안식향산 고체를 넣고 유리막대로 저어 충분히 녹인 다음 2ml를 취해 증발접시에 담아 무게를 재었다. 50℃의 경우에는 50℃로 평형이 이루어져 있는 항온조에 비커를 넣고 위와 같이 녹인 다음 2ml를 취해 증발접시와 포화용액의 무게를 재었다. 그리고 증발접시에 담긴 포화용액을 증발 건조시키고 무게를 재었다.
4. RESULTS
4.1 Raw data
Table 2. Raw data
무게(g)
실온(25℃)
항온조(50℃)
증발접시
97.71
76.60
증발접시+포화용액 2ml
99.69
78.68
포화용액 2ml
1.98
2.08
증발접시+포화용액 2ml에 녹아있는 안식향산
97.75
76.82
포화용액 2ml에 녹아있는 안식향산
0.04
0.22
4.2 Results
4.2.1 용해도
용해도(S)를 구하는 식
(m=포화용액 2ml의 무게, m\'=포화용액 2ml에 녹아있는 안식향산의 무게)
Table 3. 온도에 따른 용해도
25℃
50℃
용해도(g/100 H2O)
2.06
11.83
계산과정
Table 4. 용해도의 실험값과 문헌값
용해도(g/100g H2O)
25℃
50℃
실험 값
2.06
11.83
문헌 값
0.34
0.78
Table 5. 용해도의 오차율
25℃
50℃
오차율(%)
505.88
1416.66
계산과정
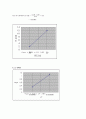
Figure 3. 용해도 vs 온도 그래프
4.2.2 용해열
Figure 4. logS vs 1/T 그래프
용해열() 구하는 식
Table 6. 용해열의 실험값과 문헌값
용해열(KJ/mol)
실험값
55.97
문헌값
26.59
5. DISCUSSION
실험 결과 25℃의 용해도는 2.06g/100g H2O, 50℃의 용해도는 11.83g/100g H2O으로 문헌값인 0.34g/100g H2O(25℃), 0.78g/100g H2O(50℃)와 비교할 때 오차가 발생하였다.
가장 중요한 오차의 원인은 안식향산의 용해도이다. 안식향산은 용해도가 매우 적기 때문에 녹이기 어려울 뿐만 아니라 적은 석출에도 큰 오차를 만든다.
또 다른 오차에는 증발접시의 수분이 있다. 증발접시에 수분이 있게 되면 무게가 더 크게 측정되는데 수분을 완전히 제거하기 어려웠기 때문에 오차가 발생하였다. 증발접시의 수분을 완전히 제거하지 않게 되면 용해도가 커지는 오차가 발생하게 된다. 따라서 증발접시의 수분을 완전히 제거하고 실험해야 한다.
그리고 50℃의 포화용액을 취할 때 온도가 내려가면서 고체가 석출될 수도 있다. 또한 용액이 과포화되면 오차가 발생하게 된다. 용액을 천천히 식히거나 용매를 서서히 증발시키면 과포화 용액이 만들어지므로 유의해야 한다.
Figure 3.을 보면 온도가 증가함에 따라 안식향산의 용해도가 증가하는 것을 볼 수 있다. 따라서 안식향산이 물에 용해되는 반응은 흡열반응임을 알 수 있었다. 이 결과는 figure 4.에서도 확인 할 수 있다. 식 (2)에 의하면 그래프의 기울기에 2.303R을 나눠주면 용해열을 구할 수 있다. 따라서 기울기가 양의 값을 갖게 되어 흡열반응이 된다. 식(2)를 이용해 직접 용해열을 구하면 55397J/mol이고, 이는 용해반응이 흡열반응임을 의미한다. 흡열 반응의 경우 온도를 높여주면 용질과 용매 주변에 충분한 열이 존재하게 되어 주변으로부터 열을 흡수하기 쉬워지기 때문에 용해도가 증가한다.
이번 실험은 비교적 간단한 실험이었지만 측정이 정밀해야 하는 실험이었다. 오차율은 크게 나왔지만 전체적으로는 이론에 맞았다.
6. REFERENCE
1. H.S.Shin. \"Fundamental Chemical Engineering Laboratory Manual\"
2. naver 백과사전
용해 과정이 발열 반응인 경우에도 그 원리는 흡열 반응의 경우와 같으며 반대의 결과를 나타낸다. 즉 온도를 높여주면 용해도가 감소하고 온도를 낮춰주면 용해도가 증가한다. 따라서 \"기울기<0(음)\"인 용해도 곡선이 그려진다.
용
해
도
NaNO3
KNO3
온 도
KCl
NaCl
Ce2(SO4)3
용해도 곡선 상의 모든 점은 그 온도에서의 포화용액을 나타내며 곡선 위의 점은 과포화 용액을, 곡선 아래의 점은 불포화용액을 나타낸다.
2.2.3 용해도 결정
포화용액에 대해서, 그 용매 100g 중의 용질의 수를 그람용해도(solubility)라 한다. 용해도는 온도에 따라서 다르고, 그 관계도가 용해도 곡선이다. 이 실험에서는 여러 가지 고체의 물에 대한 용해도를 여러 온도에서 측정하고 용해도 곡선을 그린다.
온도 t에 대해서의 용해도를 s, 그 때의 용해열 (계가 외계에서 열을 흡수했을 때, 즉 흡열을 양(+)으로 한다)가 온도에 의해서 변하지 않는다고 하면, van\'t Hoff의 이론에서
(1)
여기에서 R는 기체상수, C는 적분상수이다.
온도 T1, T2에 있어서의 용해도를 S1, S2라 하면 식 (1)에서
(2)
두 온도에 있어서의 용해도를 측정하면 이 식에서 용해열 가 계산으로 구해진다.
2.3 실험 주의사항
실온에서 고체를 거른다.
증발접시의 무게를 잴 때는 수분을 완전히 제거한다.
2.4 시약의 특성
안식향산(C6H5COOH)
물에 대한 용해도는 25℃에서 3.4g/L 이고, 뜨거운 물에서는 매우 잘 녹는다.
Table 1. 실험물리상수
시료
분자식
녹는점(℃)
끓는점(℃)
밀도(g/cm3)
용해도(g/L)
안식향산
C6H5COOH
122.4
24.9
1.32
3.4(25℃)
3. EXPERIMENTAL
3.1 기구 및 시약
기구 : 비커, 증발접시, 유리막대, 온도계, 항온조, pipette, 건조기
시약 : 증류수, 안식향산
3.2 실험절차
우선 실험에 필요한 기구와 시약을 준비하였다. 그 다음 증발 접시의 무게를 재었다. 실온에서 비커에 적당량의 증류수와 안식향산 고체를 넣고 유리막대로 저어 충분히 녹인 다음 2ml를 취해 증발접시에 담아 무게를 재었다. 50℃의 경우에는 50℃로 평형이 이루어져 있는 항온조에 비커를 넣고 위와 같이 녹인 다음 2ml를 취해 증발접시와 포화용액의 무게를 재었다. 그리고 증발접시에 담긴 포화용액을 증발 건조시키고 무게를 재었다.
4. RESULTS
4.1 Raw data
Table 2. Raw data
무게(g)
실온(25℃)
항온조(50℃)
증발접시
97.71
76.60
증발접시+포화용액 2ml
99.69
78.68
포화용액 2ml
1.98
2.08
증발접시+포화용액 2ml에 녹아있는 안식향산
97.75
76.82
포화용액 2ml에 녹아있는 안식향산
0.04
0.22
4.2 Results
4.2.1 용해도
용해도(S)를 구하는 식
(m=포화용액 2ml의 무게, m\'=포화용액 2ml에 녹아있는 안식향산의 무게)
Table 3. 온도에 따른 용해도
25℃
50℃
용해도(g/100 H2O)
2.06
11.83
계산과정
Table 4. 용해도의 실험값과 문헌값
용해도(g/100g H2O)
25℃
50℃
실험 값
2.06
11.83
문헌 값
0.34
0.78
Table 5. 용해도의 오차율
25℃
50℃
오차율(%)
505.88
1416.66
계산과정
Figure 3. 용해도 vs 온도 그래프
4.2.2 용해열
Figure 4. logS vs 1/T 그래프
용해열() 구하는 식
Table 6. 용해열의 실험값과 문헌값
용해열(KJ/mol)
실험값
55.97
문헌값
26.59
5. DISCUSSION
실험 결과 25℃의 용해도는 2.06g/100g H2O, 50℃의 용해도는 11.83g/100g H2O으로 문헌값인 0.34g/100g H2O(25℃), 0.78g/100g H2O(50℃)와 비교할 때 오차가 발생하였다.
가장 중요한 오차의 원인은 안식향산의 용해도이다. 안식향산은 용해도가 매우 적기 때문에 녹이기 어려울 뿐만 아니라 적은 석출에도 큰 오차를 만든다.
또 다른 오차에는 증발접시의 수분이 있다. 증발접시에 수분이 있게 되면 무게가 더 크게 측정되는데 수분을 완전히 제거하기 어려웠기 때문에 오차가 발생하였다. 증발접시의 수분을 완전히 제거하지 않게 되면 용해도가 커지는 오차가 발생하게 된다. 따라서 증발접시의 수분을 완전히 제거하고 실험해야 한다.
그리고 50℃의 포화용액을 취할 때 온도가 내려가면서 고체가 석출될 수도 있다. 또한 용액이 과포화되면 오차가 발생하게 된다. 용액을 천천히 식히거나 용매를 서서히 증발시키면 과포화 용액이 만들어지므로 유의해야 한다.
Figure 3.을 보면 온도가 증가함에 따라 안식향산의 용해도가 증가하는 것을 볼 수 있다. 따라서 안식향산이 물에 용해되는 반응은 흡열반응임을 알 수 있었다. 이 결과는 figure 4.에서도 확인 할 수 있다. 식 (2)에 의하면 그래프의 기울기에 2.303R을 나눠주면 용해열을 구할 수 있다. 따라서 기울기가 양의 값을 갖게 되어 흡열반응이 된다. 식(2)를 이용해 직접 용해열을 구하면 55397J/mol이고, 이는 용해반응이 흡열반응임을 의미한다. 흡열 반응의 경우 온도를 높여주면 용질과 용매 주변에 충분한 열이 존재하게 되어 주변으로부터 열을 흡수하기 쉬워지기 때문에 용해도가 증가한다.
이번 실험은 비교적 간단한 실험이었지만 측정이 정밀해야 하는 실험이었다. 오차율은 크게 나왔지만 전체적으로는 이론에 맞았다.
6. REFERENCE
1. H.S.Shin. \"Fundamental Chemical Engineering Laboratory Manual\"
2. naver 백과사전































소개글