목차
1. 결과 및 논의
2. 결론
3. reference
2. 결론
3. reference
본문내용
서 칼슘이온이 침전되는 역반응이 일어난다. 결과적으로 농도가 더 높은 수산화나트륨 용액일 수록 더 적은 칼슘 이온 농도를 보였다.
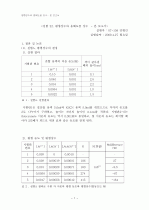
3). 각 용액에서의 용해도곱을 비교하고, 용해도곱이 상수임을 알아보자. 실험에서 얻은 값과 문헌에서 조사한 자료를 비교하여 보아라.
순수한 물
0.05M
0.10M
K_sp
6.87E-06
5.84E-05
0.000101
참값[2]
8.00E-06
%difference
1.41E+01
-6.30E+02
-1.17E+03
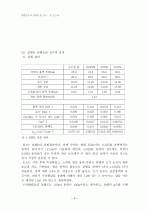
4). log[Ca2+]와 log[OH-]의 그래프를 그리고 Ksp를 구하라.
0.025M을 제외한 3가지 경우의 그래프를 그렸을 때(log는 base를 10으로 했다), 추세선의 y절편은
=-6.6867이므로 Ksp=1.55
따라서 참값인 8.00E-6과 scale은 같으나 많은 차이가 있었다.
(3). 생각해볼 사항
1). 용해도와 용해도곱 상수의 관계를 알아보아라.
용해도곱 상수는 각 이온의 몰농도의 지수를 고려한 곱인데, 용해도는 100g의 용매에 녹을 수 있는 최대 g수이므로 물질의 몰농도 X 분자량 X 0.1로 계산할 수 있다. 그러니까 수산화칼슘의 경우에는 녹은 수산화칼슘과 칼슘의 몰 수가 같으므로 [Ca2+]X0.1X분자량으로 계산할 수 있다. 따라서 용해도곱상수가 크면 용해도도 커지지만 비례한다고는 할 수 없다.
2). AgI, CuI, CaSO4의 상대적 용해도 순서?
용해도곱상수가 클 수록 잘 녹으므로 ( 값은 교과서에 있다) CaSO4>CuI>AgI 순으로 잘 녹는다.
3). 용해도는 침전을 이용한 양이온의 정성 분석에 어떻게 사용되는가?
어떤 양이온의 정성분석을 하려면 양이온을 얻고 양을 측정해야 한다. 이온을 침전시키려면 특정음이온을 넣어서 난용성염으로 만들어서 침전시켜야 한다. 실험에서는 수산화이온을 이용해서 과량의 수산화이온을 넣어서 칼슘이온을 침전시켰다. 이와 마찬가지로 음이온을 용액이 과량으로 넣어서 양이온을 충분히 침전시키고, 실험B와 같이 적정을 이용해서 음이온의 양을 구하면 양이온을 정량적으로 양을 잴 수 있고, 침전물에서 양이온을 분리해서 사용할 수 있다.
2. 결론
실험A에서는 철이온과 thiocyanate이온의 착이온 생성반응을 이용해서 비색법으로 이온 농도를 추정해서 평형상수를 구했으나, 다단계의 희석이나, 육안에 의한 식별법에 의한 오차가 커서 실험이 성공적이지 못했다. 실험B에서는 수산화칼슘을 공통이온효과로 수산화나트륨 용액 내에서 침전을 만들고, 염산으로 적정해서 수산화이온과 칼슘이온 농도를 계산, 용해도곱상수를 계산했으나, 좋은 결과를 얻지는 못했다.
3. 참고문헌
[1]. JChemEd.chem.wisc.edu Vol. 75 No. 1 January 1998 Journal of Chemical Education에서 평형상수값 발췌
[2]. http://en.wikipedia.org/wiki/Solubility_equilibrium 에서 용해도곱 상수 발췌
표준 일반화학 실험 제6개정판 실험22. 평형상수와 용해도 곱 상수 측정
3). 각 용액에서의 용해도곱을 비교하고, 용해도곱이 상수임을 알아보자. 실험에서 얻은 값과 문헌에서 조사한 자료를 비교하여 보아라.
순수한 물
0.05M
0.10M
K_sp
6.87E-06
5.84E-05
0.000101
참값[2]
8.00E-06
%difference
1.41E+01
-6.30E+02
-1.17E+03
4). log[Ca2+]와 log[OH-]의 그래프를 그리고 Ksp를 구하라.
0.025M을 제외한 3가지 경우의 그래프를 그렸을 때(log는 base를 10으로 했다), 추세선의 y절편은
=-6.6867이므로 Ksp=1.55
따라서 참값인 8.00E-6과 scale은 같으나 많은 차이가 있었다.
(3). 생각해볼 사항
1). 용해도와 용해도곱 상수의 관계를 알아보아라.
용해도곱 상수는 각 이온의 몰농도의 지수를 고려한 곱인데, 용해도는 100g의 용매에 녹을 수 있는 최대 g수이므로 물질의 몰농도 X 분자량 X 0.1로 계산할 수 있다. 그러니까 수산화칼슘의 경우에는 녹은 수산화칼슘과 칼슘의 몰 수가 같으므로 [Ca2+]X0.1X분자량으로 계산할 수 있다. 따라서 용해도곱상수가 크면 용해도도 커지지만 비례한다고는 할 수 없다.
2). AgI, CuI, CaSO4의 상대적 용해도 순서?
용해도곱상수가 클 수록 잘 녹으므로 ( 값은 교과서에 있다) CaSO4>CuI>AgI 순으로 잘 녹는다.
3). 용해도는 침전을 이용한 양이온의 정성 분석에 어떻게 사용되는가?
어떤 양이온의 정성분석을 하려면 양이온을 얻고 양을 측정해야 한다. 이온을 침전시키려면 특정음이온을 넣어서 난용성염으로 만들어서 침전시켜야 한다. 실험에서는 수산화이온을 이용해서 과량의 수산화이온을 넣어서 칼슘이온을 침전시켰다. 이와 마찬가지로 음이온을 용액이 과량으로 넣어서 양이온을 충분히 침전시키고, 실험B와 같이 적정을 이용해서 음이온의 양을 구하면 양이온을 정량적으로 양을 잴 수 있고, 침전물에서 양이온을 분리해서 사용할 수 있다.
2. 결론
실험A에서는 철이온과 thiocyanate이온의 착이온 생성반응을 이용해서 비색법으로 이온 농도를 추정해서 평형상수를 구했으나, 다단계의 희석이나, 육안에 의한 식별법에 의한 오차가 커서 실험이 성공적이지 못했다. 실험B에서는 수산화칼슘을 공통이온효과로 수산화나트륨 용액 내에서 침전을 만들고, 염산으로 적정해서 수산화이온과 칼슘이온 농도를 계산, 용해도곱상수를 계산했으나, 좋은 결과를 얻지는 못했다.
3. 참고문헌
[1]. JChemEd.chem.wisc.edu Vol. 75 No. 1 January 1998 Journal of Chemical Education에서 평형상수값 발췌
[2]. http://en.wikipedia.org/wiki/Solubility_equilibrium 에서 용해도곱 상수 발췌
표준 일반화학 실험 제6개정판 실험22. 평형상수와 용해도 곱 상수 측정



























소개글