목차
1. Title
2. Date
3. Purpose
4. Principle
5. Apparatus & Reagents
6. Procedure
7. Experiment Illustration
8. Result
9. Observation
10. Discussion
11. Reference
2. Date
3. Purpose
4. Principle
5. Apparatus & Reagents
6. Procedure
7. Experiment Illustration
8. Result
9. Observation
10. Discussion
11. Reference
본문내용
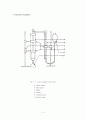
jacket에는 물이 1/3(내부에 충분히 열전달이 가능한 양)정도 차도록 물을 붓는다. 주의해야 할 점은 내부 유리관이 장착되어 있을 시 물이 1/3정도 차야하므로 내부유리관을 장착하기 전 물을 넣을시 1/3이 조금 안되도록 넣어야한다(물이 너무 많아 중탕 가열시 시간이 오래 걸 수 있다.). 내부 유리관을 장착할 시 고무마개를 통해 내부유리관을 고정시키게 되는데 이 때 고무마개로 과하게 막을 경우 수증기팽창에 의한 폭발이 일어날 수 있으므로 주의하도록 해야 한다.
장치 내부 전체에 열이 고르게 퍼지도록 하고, 열손실을 최소화 하기위해 outer jacket 상단 부분과 gas buret 연결 호스에 호일로 감싸준다.
leveling bulb에는 gas buret의 수위가 0이 되도록 물을 채운다. 장치 설치가 완료되면 alcohol lamp를 이용하여 가열한다. 이때 가열은 충분히(끓을 때까지) 해줘야한다.
중탕열보다 b.p가 낮은 시약을 사용해야 총괄적인 기화가 가능하므로 ether를 측정한다. Ether는 그 기화성이 강하기 때문에 실험을 신속히 진행하도록 해야한다. 주사기를 이용하여 ether를 주입하게 되는데, ether기체의 질량은 주사기만의 질량과 ether가 들어간 주사기의 질량을 각각 측정하여 구한다. 주사기에 ether를 넣을 때의 손실을 막기 위해 주사기 마개로 주입 전까지 막아준다.
Outer jacket의 주입구를 고무마개로 막아주고, 주사기를 통해 ether를 주입한다. 이때의 손실을 막기 위해 주입 후 고무마개 부분에 para film으로 신속히 차단해야한다. 주입도 신속히 해야 하는데, 그러지 않을 경우 주입한 구멍을 통해 손실하게 된다. 이는 주입구에 나오는 연기에 의해 확인 할 수 있다.
최대한 빠른 기화를 위해 주입 시 시약이 outer jacket의 벽면을 타지 않도록 한다. 벽면을 타고 흐를 경우 기화되지 않고 소량이 벽면에 남아 있게 되어 오차가 발생할 수 있다.
Ether를 주입하게 되면 바로 gas buret의 수위가 낮아지게 된다. Leveling bulb도 함께 수위를 맞춰가며 따라 내려가면서 읽는다. 이 때 주의 사항은 gas buret의 수위가 낮아짐에 따라 leveling bulb를 위치를 변화시켜 수위를 맞추지 않고, gas buret보다 leveling bulb를 인위적으로 위치를 변화시킬시 수위의 측정이 부정확하게 된다. 그러므로 gas buret의 수위 내려가는 정도에 따라 조금씩 leveling bulb의 위치를 변화시켜 주어야한다.
이 과정을 반복을 통해 측정하게 되는데, 재실험시 전 실험에서 기화하지 않은 ether가 남아 있을 수 있으므로 실험이 끝나면 고무마개를 제거하여 남아있는 소량의 ether가 전부 기화 되어 제거 될 수 있도록 충분한 시간동안 중탕 후 실험을 해야 한다. 소량의 ether라도 기체이기 때문에 큰 오차가 발생 될 수 있다.
반복 측정한 측정값을 통해 ether의 분자량을 구한다.
10. Discussion
* 분자량 측정
산소 분자의 질량을 32라 정하고 이것을 기준으로 하는 다른 분자의 상대적인 질량을 그 분자의 분자량이라고 한다. 분자량은 무명수이다. 분자가 실재하는 것이 실험적으로 알려져 있는 물질에 대해서만 분자량이라는 말을 사용할 수 있다. 원래는 분자의 실재가 확실하지 않은 물질에 대하여도 분자량이라는 말을 사용하고 , 그 물질의 화학적 지식을 이용하여 원자량의 총합으로서 분자량을 구했었다. 탄산칼슘도 K, C, O 의 원자량에서 구해진 값을 분자량이라고 했다. 그러나 탄산칼슘이라는 분자로 존재하지 않으므로 정확히 말하면 분자량을 말할 수 없다.
예를 들면, 염화나트륨 NaCl의 결정에서 NaCl로 나타내는 분자는 존재하지 않지만, 그 식량은 NaCl=22.9898+35.453=58.4428이며 이 값을 분자량으로 한다. 분자량은 기체인 경우에는 이상기체의 상태방정식으로부터 그 대략의 값을 알 수 있고, 또 비휘발성 물질에서는 용액을 만들어 그 용액의 어는점내림 또는 끓는점 오름으로부터 실험적으로 대략의 값을 구할 수 있다.
다시 원소분석에 의하여 그 물질의 실험식을 얻고 이 실험식과 위의 실험에서 얻은 대략의 값으로부터 분자식을 만든다. 이 분자식의 원자량의 총합을 정확한 분자량 값으로 한다. 그러나 분자량이 큰 고분자화합물에서는 광산란삼투압확산계수침강속도점성도 등을 이용하여 측정하지만 여러 가지 분자의 고분자가 공존하고 있기 때문에 평균분자량이 되는 경우가 많다.
[Table 1-6. 분자량측정 ]
상태
방법
참고
기체
기체
밀도
측정
직
접
측
정
독립 변수
종속 변수
T , p , V
T , m
T , p , m
T , V, m
m 뒤마법, 르뇨법
p, V 게이뤼삭-호프만의 증기 밀도 측정
V 빅터-마이어법
p 브래크만-멘지스법
유출법→ 그레이엄의 법칙
용액
열적
성질
증기압 내립법→증기압 내림
어는점법
끓는점법
삼투압법
* 빅터 마이어법 (Victor Meyer method)
기화하기 쉬운 액체의 증기 밀도를 측정하여 분자량을 측정하는 방법이다.
1878년 독일의 v. 마이어가 고안했다. 가스뷰렛 속에 들어 있는 공기의 부피를 V Cm2라한다. 이것은 시료 물질의 증기가 고온에서 차지하는 부피와 같은 부피의 공기 온도가 실온 t℃로 내려갔을 때의 부피이다. 이 공기 속에서는 가스뷰렛 안의 물이 증발하여 거의 포화되어 있다고 생각한다.
t℃에서의 물의 포화증기압을 p'mmHg 라고 하면 건조공기의 부분압력 (P-P')mmHg이다. 이 공기의 부피를 0℃. 1atm으로 환산하면
가 된다. V0는 시료물질 0℃, 1atm에서 기체일 때 차지하는 부피이다.
처음에 채취, 칭량한 시료가 Wg이었다면 이 물질의 0℃,1atm에서의 가상적인 공기밀도는 W/V0 gcm-3이다. 이로부터 이 물질과 분자량은 22.414×W/V0 주어진다.
11. Reference
- 물리화학 3rd / R.J.Silbey / John Wiley & Sons Inc.
- THE MERCK INDEX/ Susan Budavari저 / MERCK& Co.,INC.
장치 내부 전체에 열이 고르게 퍼지도록 하고, 열손실을 최소화 하기위해 outer jacket 상단 부분과 gas buret 연결 호스에 호일로 감싸준다.
leveling bulb에는 gas buret의 수위가 0이 되도록 물을 채운다. 장치 설치가 완료되면 alcohol lamp를 이용하여 가열한다. 이때 가열은 충분히(끓을 때까지) 해줘야한다.
중탕열보다 b.p가 낮은 시약을 사용해야 총괄적인 기화가 가능하므로 ether를 측정한다. Ether는 그 기화성이 강하기 때문에 실험을 신속히 진행하도록 해야한다. 주사기를 이용하여 ether를 주입하게 되는데, ether기체의 질량은 주사기만의 질량과 ether가 들어간 주사기의 질량을 각각 측정하여 구한다. 주사기에 ether를 넣을 때의 손실을 막기 위해 주사기 마개로 주입 전까지 막아준다.
Outer jacket의 주입구를 고무마개로 막아주고, 주사기를 통해 ether를 주입한다. 이때의 손실을 막기 위해 주입 후 고무마개 부분에 para film으로 신속히 차단해야한다. 주입도 신속히 해야 하는데, 그러지 않을 경우 주입한 구멍을 통해 손실하게 된다. 이는 주입구에 나오는 연기에 의해 확인 할 수 있다.
최대한 빠른 기화를 위해 주입 시 시약이 outer jacket의 벽면을 타지 않도록 한다. 벽면을 타고 흐를 경우 기화되지 않고 소량이 벽면에 남아 있게 되어 오차가 발생할 수 있다.
Ether를 주입하게 되면 바로 gas buret의 수위가 낮아지게 된다. Leveling bulb도 함께 수위를 맞춰가며 따라 내려가면서 읽는다. 이 때 주의 사항은 gas buret의 수위가 낮아짐에 따라 leveling bulb를 위치를 변화시켜 수위를 맞추지 않고, gas buret보다 leveling bulb를 인위적으로 위치를 변화시킬시 수위의 측정이 부정확하게 된다. 그러므로 gas buret의 수위 내려가는 정도에 따라 조금씩 leveling bulb의 위치를 변화시켜 주어야한다.
이 과정을 반복을 통해 측정하게 되는데, 재실험시 전 실험에서 기화하지 않은 ether가 남아 있을 수 있으므로 실험이 끝나면 고무마개를 제거하여 남아있는 소량의 ether가 전부 기화 되어 제거 될 수 있도록 충분한 시간동안 중탕 후 실험을 해야 한다. 소량의 ether라도 기체이기 때문에 큰 오차가 발생 될 수 있다.
반복 측정한 측정값을 통해 ether의 분자량을 구한다.
10. Discussion
* 분자량 측정
산소 분자의 질량을 32라 정하고 이것을 기준으로 하는 다른 분자의 상대적인 질량을 그 분자의 분자량이라고 한다. 분자량은 무명수이다. 분자가 실재하는 것이 실험적으로 알려져 있는 물질에 대해서만 분자량이라는 말을 사용할 수 있다. 원래는 분자의 실재가 확실하지 않은 물질에 대하여도 분자량이라는 말을 사용하고 , 그 물질의 화학적 지식을 이용하여 원자량의 총합으로서 분자량을 구했었다. 탄산칼슘도 K, C, O 의 원자량에서 구해진 값을 분자량이라고 했다. 그러나 탄산칼슘이라는 분자로 존재하지 않으므로 정확히 말하면 분자량을 말할 수 없다.
예를 들면, 염화나트륨 NaCl의 결정에서 NaCl로 나타내는 분자는 존재하지 않지만, 그 식량은 NaCl=22.9898+35.453=58.4428이며 이 값을 분자량으로 한다. 분자량은 기체인 경우에는 이상기체의 상태방정식으로부터 그 대략의 값을 알 수 있고, 또 비휘발성 물질에서는 용액을 만들어 그 용액의 어는점내림 또는 끓는점 오름으로부터 실험적으로 대략의 값을 구할 수 있다.
다시 원소분석에 의하여 그 물질의 실험식을 얻고 이 실험식과 위의 실험에서 얻은 대략의 값으로부터 분자식을 만든다. 이 분자식의 원자량의 총합을 정확한 분자량 값으로 한다. 그러나 분자량이 큰 고분자화합물에서는 광산란삼투압확산계수침강속도점성도 등을 이용하여 측정하지만 여러 가지 분자의 고분자가 공존하고 있기 때문에 평균분자량이 되는 경우가 많다.
[Table 1-6. 분자량측정 ]
상태
방법
참고
기체
기체
밀도
측정
직
접
측
정
독립 변수
종속 변수
T , p , V
T , m
T , p , m
T , V, m
m 뒤마법, 르뇨법
p, V 게이뤼삭-호프만의 증기 밀도 측정
V 빅터-마이어법
p 브래크만-멘지스법
유출법→ 그레이엄의 법칙
용액
열적
성질
증기압 내립법→증기압 내림
어는점법
끓는점법
삼투압법
* 빅터 마이어법 (Victor Meyer method)
기화하기 쉬운 액체의 증기 밀도를 측정하여 분자량을 측정하는 방법이다.
1878년 독일의 v. 마이어가 고안했다. 가스뷰렛 속에 들어 있는 공기의 부피를 V Cm2라한다. 이것은 시료 물질의 증기가 고온에서 차지하는 부피와 같은 부피의 공기 온도가 실온 t℃로 내려갔을 때의 부피이다. 이 공기 속에서는 가스뷰렛 안의 물이 증발하여 거의 포화되어 있다고 생각한다.
t℃에서의 물의 포화증기압을 p'mmHg 라고 하면 건조공기의 부분압력 (P-P')mmHg이다. 이 공기의 부피를 0℃. 1atm으로 환산하면
가 된다. V0는 시료물질 0℃, 1atm에서 기체일 때 차지하는 부피이다.
처음에 채취, 칭량한 시료가 Wg이었다면 이 물질의 0℃,1atm에서의 가상적인 공기밀도는 W/V0 gcm-3이다. 이로부터 이 물질과 분자량은 22.414×W/V0 주어진다.
11. Reference
- 물리화학 3rd / R.J.Silbey / John Wiley & Sons Inc.
- THE MERCK INDEX/ Susan Budavari저 / MERCK& Co.,INC.
키워드
추천자료
 전분(starch)제조 및 현미경으로 전분 입자 관찰
전분(starch)제조 및 현미경으로 전분 입자 관찰 고분자 공정
고분자 공정 [식품분석 및 실험] 유지의 화학적 성질
[식품분석 및 실험] 유지의 화학적 성질 고분자 용액의 점성도 측정(Viscosity of High-polymer solution)
고분자 용액의 점성도 측정(Viscosity of High-polymer solution) 칼슘 조절 호르몬 체계
칼슘 조절 호르몬 체계 폴리스티렌 중합
폴리스티렌 중합 폴리스틸렌 실험 예비 보고서(화공기초실험)
폴리스틸렌 실험 예비 보고서(화공기초실험) [생화학 실험] SDS-PAGE & Bradford assay
[생화학 실험] SDS-PAGE & Bradford assay  고분자의 용융흐름지수측정
고분자의 용융흐름지수측정 대기오염물질 5
대기오염물질 5 MMA의 Bulk 중합 : 단량체 정제, 중합, 분석
MMA의 Bulk 중합 : 단량체 정제, 중합, 분석  중합공학실험_페놀수지 합성
중합공학실험_페놀수지 합성 화학chemistry 공정실험보고서 현탁중합에 의한 PPM의 제조 및 산가 측정
화학chemistry 공정실험보고서 현탁중합에 의한 PPM의 제조 및 산가 측정 항성의 스펙트럼 분류와 H-R도에 대한 자료
항성의 스펙트럼 분류와 H-R도에 대한 자료