목차
Ⅰ. 실험제목
Ⅱ. 목 적
Ⅲ. 준 비 물
Ⅳ. 이론적 배경
1. 다니엘 전지
2. 다니엘 전지의 구조
3. 다니엘 전지의 반응식
4. 전지의 표시법
5. 염다리
6. 0.5M CuSO4 제조
7. 각몰 농도의 ZnSO4 제조
8. Nernst Equation
Ⅴ. 방 법
Ⅵ. 결 과
1. 전체 반응식
2. 이론값, 실험값 구하기
3. 상대오차
4. 그 래 프
5. 염다리(salt bridge)의 종류와 역할
6. EMF series와 Galvanic Series 설명과 차이점
Ⅶ. 고 찰
Ⅱ. 목 적
Ⅲ. 준 비 물
Ⅳ. 이론적 배경
1. 다니엘 전지
2. 다니엘 전지의 구조
3. 다니엘 전지의 반응식
4. 전지의 표시법
5. 염다리
6. 0.5M CuSO4 제조
7. 각몰 농도의 ZnSO4 제조
8. Nernst Equation
Ⅴ. 방 법
Ⅵ. 결 과
1. 전체 반응식
2. 이론값, 실험값 구하기
3. 상대오차
4. 그 래 프
5. 염다리(salt bridge)의 종류와 역할
6. EMF series와 Galvanic Series 설명과 차이점
Ⅶ. 고 찰
본문내용
1151 V
1.082 V
[구리 반쪽 전지] (+)극 : Cu2+ (1M) + 2e- → Cu(s) E0 = + 0.34V
[아연 반쪽 전지] (-)극 : Zn(s) → Zn2+ (1M) + 2e+ E0 = - 0.76V
[전 체] Zn(s) + Cu2+ (1M) → Zn2+ (1M) + Cu(s)
아연-구리 화학전지의 기전력 E0 = 0.34V - (-0.76V) = 1.10V
Z : 반응에 참가 하지 않은 전자 수 F : 반응에 참여한 총 전자 수 (C : 쿨롱)
T : 25℃ (298K) a : 활동도 R : 8.314J/k■mole
1조
2조
3조
4조
3. 상대오차
조 별
1조
2조
3조
4조
상대오차
4.64%
3.28%
1.96%
2.97%
1조
2조
3조
4조
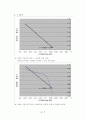
4. 그 래 프
※ 그래프 기울기의 역수 = 전자의 수를 이다.
기울기의 역수는 1.998로 전자의 수 2와 거의 같다.
※ 그래프 기울기의 역수는 3.805로써 전자의 수와 큰 차이를 보인다.
5. 염다리(salt bridge)의 종류와 역할
(1) 염다리의 역할
전지가 일을 하기 위해서는 양쪽의 용액, 즉 반쪽전지가 전기적으로 중성을 유지해야 한다. 다니엘 전지와 같이 아연이 산화될 때 전극 주변에 Zn2+가 생겨 전하균형을 위해 음이온이 필요하다. 마찬가지로 Cu2+ 이온이 환원될 때, 용액에 SO42- 이온만 남게되어 중성을 유지하기 위해 양이온이 필요하다. 따라서 염다리는 산화되는 전극으로는 Cl-이, 환원되는 전극위 용액으로는 K+가 이동하여 전기적인 중성을 유지시켜주면서 용액이 직접 섞이지 않도록 하는 역할을 한다.
반쪽반응이 일어나는 각각의 실험장치에서 산화반응이 일어나는 곳과 환원반응이 일어나는 곳이, 직접 전자를 주고받지 못하게 이온을 분리시켜 주는 작용을 하는 역할을 수행한다.
흔히 생각할 때 염다리로 전류가 흐른다고 착각을 할 우려가 있다. 그러나 염다리를 회로에 설치하는 이유는 두 극이 담겨져 있는 전해질 용액사이에 발생하는 potential의 차이를 줄이기 위해서이다. 화학전지에서 기전력의 원동력은 양쪽 전극 사이의 표준전극전위의 차이가 된다. 그러나 이 차이는 두 극이 담겨있는 용액속의 양이온 또는 음이온의 농도가 달라짐에 따라 전위가 달라져서 표준전극전위차가 줄어들게 되어 마침내 기전력이 상쇄되어 버리고 만다. 이때 염다리는 전류가 흐르도록 이온의 농도를 일정하게 유지시켜준다.
(2) 염다리의 종류
1) U자관에 한천과 염의 혼합 용액을 넣어 응고시킨 것으로
2) 음양 두 이온의 이동도의 차가 될 수 있는 대로 작은 염, 즉 KCl, KNO3의 염을 사용
3) 킴테크 킴와이프스
4) 초벌구이 사기그릇
5) 셀로판종이
6-1. 효율이 50%라고 가정할 때 Cu 1mol, Ag 1mol을 얻기위한 전기량은?
(1) Cu 1mol을 얻기위한 전하량
Q(C) = n(전자수) × F(96500C/mole) × (석출량/원자량)
= 2 × 96500 ×
= 193000 C
효율이 50%이므로 필요한 전하량은 386000C
(2) Ag 1mol을 얻기위한 전하량
Q(C) = n(전자수) × F(96500C/mole) × (석출량/원자량)
= 1 × 96500 ×
= 96500 C
효율이 50%이므로 필요한 전하량은 193000C
6.-2. EMF series와 Galvanic Series 설명과 차이점?
(1) 기전력 계열(起電力系列, EMF series)
가역전지 전위순으로 금속을 배열한 것을 말하며, 이는 산화-환원 전위순으로 배열한 것이다. 산화-환원전위를 줄여서 리덕스 전위(Redox potentical)라 부르기도 한다.
(2) 갈바닉 계열(galvanic series)
각종 금속 및 합금의 자연전위를(Ecorr) 순위대로 나열한 것이다. 갈바닉 계열에서 상대적으로 전위가 높은 쪽을 귀한 전위(貴電位), 낮은 쪽은 비한 전위(卑電位)라 한다.
(3) 부식전위열(腐蝕電位列, galvanic series)
어떤 환경에서 금속 및 합금의 자연전위를 실측하여 그 크기의 순서로 배열한 서열. 금속의 이온화서열이 순금속에 대해 이론적으로 구한 표준전극전위를 기초로 하는 데 비하여, 부식전위서열은 실측값을 기초로 하기 때문에 합금재료에 대해서도 순위를 매길 수 있어 이종금속(異種金屬)의 접촉부식 가능성을 추측하는 데 도움이 된다. 환경이 변하면 순위도 당연히 변한다. 2개의 금속재료를 접촉시킬 때, 부식전위서열에서 상대적으로 낮은 쪽에 위치한 금속은 부식이 가속화될 위험성을 가진다. 실제의 부식속도에는 여러 가지 조건이 관여하기 때문에 부식전위서열에서 떨어진 위치에 있는 재료끼리 조합시켜도 문제가 없는 경우도 있지만, 일반론으로는 이러한 조합은 피해야 한다.
(4) 차이점 : 전극반응이 평형상태가 아니기 때문에 Galvanic Series 는 EMF Series 와 꼭 일치하지 않는다.
Ⅶ. 고 찰
다니엘 전지를 만들어보고 ZnSO4 몰량 변화에 따른 기전력 차이를 알아보았다. Nernst 식에 의해서 알 수 있듯이 표준상태이고 용액농도가 각각 1mol일때 기전력 1.1V이다. 이론값 및 실험값을 통해서 다음과 같은 결과를 알 수가 있다. ZnSO4 몰수가 증가 할수록 기전력 값이 작아지는 반비례함을 알 수 있었다. 이 결과값을 통하여 더 좋은 기전력을 얻기 위해서는 ZnSO4 몰수를 작게 하고 낮은 기전력을 얻기 위해서는 ZnSO4 몰수를 높게 해야 함을 알 수 있다.
ZnSO4 0.5M의 결과 값도 예상할 수 있다. Nernst 식에서 알 수 있듯이 반응물과 생성물의 몰수가 같으면 기전력이 0임을 알 수가 있다.
상대오차 및 그래프를 통해서 오차를 확인 할 수 있었다. 각 조별로 1.97% ~ 4.64%의 오차가 발생했다. 그 오차의 원인은 다음과 같다.
오차는 아주 작은데서 발생한거 같다. 첫째 Cu Plate와 Al Plate를 지지하는 스탠드 없이 비커에 넣어 두었기 때문에 담겨져 있는 면적부분만 반응에 참여하기 때문에 그만큼 오차가 발생하였으며, 둘째 아연을 무게를 측정할적에, 셋째 일정하지 못한 금속Plate 등에서 발생하였다.
1.082 V
[구리 반쪽 전지] (+)극 : Cu2+ (1M) + 2e- → Cu(s) E0 = + 0.34V
[아연 반쪽 전지] (-)극 : Zn(s) → Zn2+ (1M) + 2e+ E0 = - 0.76V
[전 체] Zn(s) + Cu2+ (1M) → Zn2+ (1M) + Cu(s)
아연-구리 화학전지의 기전력 E0 = 0.34V - (-0.76V) = 1.10V
Z : 반응에 참가 하지 않은 전자 수 F : 반응에 참여한 총 전자 수 (C : 쿨롱)
T : 25℃ (298K) a : 활동도 R : 8.314J/k■mole
1조
2조
3조
4조
3. 상대오차
조 별
1조
2조
3조
4조
상대오차
4.64%
3.28%
1.96%
2.97%
1조
2조
3조
4조
4. 그 래 프
※ 그래프 기울기의 역수 = 전자의 수를 이다.
기울기의 역수는 1.998로 전자의 수 2와 거의 같다.
※ 그래프 기울기의 역수는 3.805로써 전자의 수와 큰 차이를 보인다.
5. 염다리(salt bridge)의 종류와 역할
(1) 염다리의 역할
전지가 일을 하기 위해서는 양쪽의 용액, 즉 반쪽전지가 전기적으로 중성을 유지해야 한다. 다니엘 전지와 같이 아연이 산화될 때 전극 주변에 Zn2+가 생겨 전하균형을 위해 음이온이 필요하다. 마찬가지로 Cu2+ 이온이 환원될 때, 용액에 SO42- 이온만 남게되어 중성을 유지하기 위해 양이온이 필요하다. 따라서 염다리는 산화되는 전극으로는 Cl-이, 환원되는 전극위 용액으로는 K+가 이동하여 전기적인 중성을 유지시켜주면서 용액이 직접 섞이지 않도록 하는 역할을 한다.
반쪽반응이 일어나는 각각의 실험장치에서 산화반응이 일어나는 곳과 환원반응이 일어나는 곳이, 직접 전자를 주고받지 못하게 이온을 분리시켜 주는 작용을 하는 역할을 수행한다.
흔히 생각할 때 염다리로 전류가 흐른다고 착각을 할 우려가 있다. 그러나 염다리를 회로에 설치하는 이유는 두 극이 담겨져 있는 전해질 용액사이에 발생하는 potential의 차이를 줄이기 위해서이다. 화학전지에서 기전력의 원동력은 양쪽 전극 사이의 표준전극전위의 차이가 된다. 그러나 이 차이는 두 극이 담겨있는 용액속의 양이온 또는 음이온의 농도가 달라짐에 따라 전위가 달라져서 표준전극전위차가 줄어들게 되어 마침내 기전력이 상쇄되어 버리고 만다. 이때 염다리는 전류가 흐르도록 이온의 농도를 일정하게 유지시켜준다.
(2) 염다리의 종류
1) U자관에 한천과 염의 혼합 용액을 넣어 응고시킨 것으로
2) 음양 두 이온의 이동도의 차가 될 수 있는 대로 작은 염, 즉 KCl, KNO3의 염을 사용
3) 킴테크 킴와이프스
4) 초벌구이 사기그릇
5) 셀로판종이
6-1. 효율이 50%라고 가정할 때 Cu 1mol, Ag 1mol을 얻기위한 전기량은?
(1) Cu 1mol을 얻기위한 전하량
Q(C) = n(전자수) × F(96500C/mole) × (석출량/원자량)
= 2 × 96500 ×
= 193000 C
효율이 50%이므로 필요한 전하량은 386000C
(2) Ag 1mol을 얻기위한 전하량
Q(C) = n(전자수) × F(96500C/mole) × (석출량/원자량)
= 1 × 96500 ×
= 96500 C
효율이 50%이므로 필요한 전하량은 193000C
6.-2. EMF series와 Galvanic Series 설명과 차이점?
(1) 기전력 계열(起電力系列, EMF series)
가역전지 전위순으로 금속을 배열한 것을 말하며, 이는 산화-환원 전위순으로 배열한 것이다. 산화-환원전위를 줄여서 리덕스 전위(Redox potentical)라 부르기도 한다.
(2) 갈바닉 계열(galvanic series)
각종 금속 및 합금의 자연전위를(Ecorr) 순위대로 나열한 것이다. 갈바닉 계열에서 상대적으로 전위가 높은 쪽을 귀한 전위(貴電位), 낮은 쪽은 비한 전위(卑電位)라 한다.
(3) 부식전위열(腐蝕電位列, galvanic series)
어떤 환경에서 금속 및 합금의 자연전위를 실측하여 그 크기의 순서로 배열한 서열. 금속의 이온화서열이 순금속에 대해 이론적으로 구한 표준전극전위를 기초로 하는 데 비하여, 부식전위서열은 실측값을 기초로 하기 때문에 합금재료에 대해서도 순위를 매길 수 있어 이종금속(異種金屬)의 접촉부식 가능성을 추측하는 데 도움이 된다. 환경이 변하면 순위도 당연히 변한다. 2개의 금속재료를 접촉시킬 때, 부식전위서열에서 상대적으로 낮은 쪽에 위치한 금속은 부식이 가속화될 위험성을 가진다. 실제의 부식속도에는 여러 가지 조건이 관여하기 때문에 부식전위서열에서 떨어진 위치에 있는 재료끼리 조합시켜도 문제가 없는 경우도 있지만, 일반론으로는 이러한 조합은 피해야 한다.
(4) 차이점 : 전극반응이 평형상태가 아니기 때문에 Galvanic Series 는 EMF Series 와 꼭 일치하지 않는다.
Ⅶ. 고 찰
다니엘 전지를 만들어보고 ZnSO4 몰량 변화에 따른 기전력 차이를 알아보았다. Nernst 식에 의해서 알 수 있듯이 표준상태이고 용액농도가 각각 1mol일때 기전력 1.1V이다. 이론값 및 실험값을 통해서 다음과 같은 결과를 알 수가 있다. ZnSO4 몰수가 증가 할수록 기전력 값이 작아지는 반비례함을 알 수 있었다. 이 결과값을 통하여 더 좋은 기전력을 얻기 위해서는 ZnSO4 몰수를 작게 하고 낮은 기전력을 얻기 위해서는 ZnSO4 몰수를 높게 해야 함을 알 수 있다.
ZnSO4 0.5M의 결과 값도 예상할 수 있다. Nernst 식에서 알 수 있듯이 반응물과 생성물의 몰수가 같으면 기전력이 0임을 알 수가 있다.
상대오차 및 그래프를 통해서 오차를 확인 할 수 있었다. 각 조별로 1.97% ~ 4.64%의 오차가 발생했다. 그 오차의 원인은 다음과 같다.
오차는 아주 작은데서 발생한거 같다. 첫째 Cu Plate와 Al Plate를 지지하는 스탠드 없이 비커에 넣어 두었기 때문에 담겨져 있는 면적부분만 반응에 참여하기 때문에 그만큼 오차가 발생하였으며, 둘째 아연을 무게를 측정할적에, 셋째 일정하지 못한 금속Plate 등에서 발생하였다.































소개글