
|
I. pH의 정의
pH = - log10 {수소 이온의 농도}
pH = -log10{수소이온의 activity}= -log10{수소이온의 농도×activity constant}
Activity constant는 이온이 화학반응에 참여하는 정도를 표시한 양으로 묽은 용액처럼 이온수가
적을 경우 1.0이며 이온 농도가
|
- 페이지 7페이지
- 가격 1,300원
- 등록일 2005.06.23
- 파일종류 워드(doc)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|

|
pH를 측정하고, 이것으로 적정곡선을 작성하여 당량점을 구한다.
2. 실험원리
1) pH란?
pH는 어떤 물질이 용액 속에 용해되어 전체가 용액상태가 되었을 때, 그 용액 속에 함유되어 있는 수소이온농도를 표시하는 단위이다. pH는 수용액의 H
|
- 페이지 4페이지
- 가격 1,400원
- 등록일 2010.01.05
- 파일종류 워드(doc)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|

|
pH 8.3 이하로 내려가면 탄산 수소 이온이 탄산으로 전환되며 이때까지 주입된 산을 CaCO3로 환산한 것이다.
온도와 pH와의 관계
온도가 높으면 수용액 중의 H+의 활동도가 높아지기 때문에 pH가 올라간다. 때문에 시료의 온도는 pH 표준액의 온도
|
- 페이지 12페이지
- 가격 2,000원
- 등록일 2005.01.26
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
pH는 약 5.45이고 pKa도 5.45가 된다. pKa = -logKa의 공식을 이용하면 Ka는 3.55*10-6가 되고 이 때에는 Ka = [H+]이므로 수소이온의 농도 역시 3.55*10-6가 된다.
0.1N의 수산화나트륨을 당량점인 9.15까지 약 15.7mL 사용하였고 실험에 사용된 초산은 125mL이므로
|
- 페이지 6페이지
- 가격 1,800원
- 등록일 2014.06.05
- 파일종류 한글(hwp)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|

|
pH 페이퍼는 용액의 산성/염기성의 성향과 pH의 대략적인 범위만 알려주기 때문에 정확한 pH 측정이 불가능했던 점이 조금 아쉽다.
pH는 상술한 것처럼 수소 이온이 물에 녹아있는 정도를 수치화 한 값이기 때문에 용액에 녹아있는 수소 이온의
|
- 페이지 6페이지
- 가격 1,300원
- 등록일 2014.10.17
- 파일종류 한글(hwp)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|

|
pH의 변화이유는 음료의 산성도를 결정하는 구연산이 대체로 온도에 관계없이 녹아있지만 탄산음료의 주범인 탄산이온은 방치하면 음료수 내에서 CO2가 되어 공기 중으로 방출됩니다. (김이 빠진다고 한다.) 콜라를 마시다가 밖에 방치해두면
|
- 페이지 3페이지
- 가격 1,000원
- 등록일 2015.02.23
- 파일종류 한글(hwp)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|

|
반응하게 되는데 이 때 용액의 수소 이온 농도에 따라 반응 후의 색깔이 달라지기 때문에 이 색깔 변화를 관찰하여 이를 표준 변색표와 비교하면 용액의 pH를 알아낼 수 있다.
양배추 지시약에는 '안토시아닌'이라는 색소가 있는데, 이 색소는
|
- 페이지 6페이지
- 가격 1,200원
- 등록일 2010.03.25
- 파일종류 한글(hwp)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|
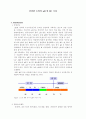
|
수소이온이나 염기성의 수산화이온이 모두 치환되어 남아 있는 수소이온이나 수산화이온이 없는 염을 말한다. 그런데 이때 주의해야 할 점은 염의 종류가 염이 물에 녹았을 때의 pH를 알려주는 것은 아니라는 점이다. 즉 산성염이라고 해서
|
- 페이지 9페이지
- 가격 2,300원
- 등록일 2012.04.16
- 파일종류 한글(hwp)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|

|
는 것이다.
덧붙이면 증류수 와 토양의 비율이 1:5보다 1:2로 혼합한 것을 비교했을 때 증류수의 비율을 크게 할수록 pH 값은 높아진다는 것을 알 수 있다. 이는 증류수는 확산이중층내의 수소이온을 용출해내지 못하므로 유리수소이온에 비해
|
- 페이지 3페이지
- 가격 2,000원
- 등록일 2011.01.10
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
⇒ 2H2O +NAD+ 개요
※제한요인의 개념설명
1.온도
- 제한요인으로서의 온도 설명
1)내성범위
2)온도의 가변성
3)미생물 에게서 온도가 제한요인으로 작용하는 예
2.빛
3.흐름과 압력
4.토양
5.수소이온농도
6.산화환원전위
7.산소
|
- 페이지 10페이지
- 가격 1,000원
- 등록일 2010.05.20
- 파일종류 한글(hwp)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|