
|
= 65.7255 60.8138
= 4.9117 g
NaOH 표준 용액의 농도
0.500 mol/L
당량점(종말점)까지 넣어 준 NaOH 용액의 부피
11.01 mL
식초에서 아세트산의 농도
1.10 mol/L
아세트산의 몰질량
60.05 g/mol
식초에서 아세트산의 질량
330 10 g
식초에서 아세트산의 % 농도
6.72 %
**
|
- 페이지 11페이지
- 가격 1,500원
- 등록일 2019.11.20
- 파일종류 한글(hwp)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|

|
아세트산이온
의 pH기여도는 작다.
[OH-] ≒ NaOH의 농도 =
= 0.0192 M
pOH = -log0.0192 = 1.72
pH = 14.00 - 1.72 = 12.28
▷ 염기를 30mL 첨가한 후의 pH
이때는 NaOH가 과량으로 존재하게 되고 NaOH는 강염기이므로 약염기인 아세트산이온
의 pH기여도는 작다.
[OH-]
|
- 페이지 8페이지
- 가격 8,400원
- 등록일 2015.04.15
- 파일종류 한글(hwp)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|

|
20ml = 0.1N * 24.0ml) , ((x)=), ((x)=0.120N)
위에서 구해진 각각의 값들을 바탕으로 오차율을 구해보면, (실험치는 종말점, 이론치는 당량점에서 구한 산 농도이므로)
-. HCl의 경우:
x 100(%)= 0.43%
-. CH3COOH의 경우:
x 100(%)= 0.83%
위로부터, 종말점에 의해 구
산과 염기 종말점, 산염기적정 당량점, 화학실험-산과 염기, 산염기적정과 pH 변화, 산해리상수 (당량점, 종말점, 몰농도, 노르말농도, 몰랄농도,,
|
- 페이지 10페이지
- 가격 1,300원
- 등록일 2007.03.24
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|
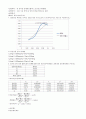
|
(제8판)』,자유아카데미,2012,pp426~427
Willard,Dean,Merritt,Settle『기기분석방법』,대웅출판사,1994,pp109~112 *실험제목 : 총 인측정-흡광광도법(아스코르빈산 환원법)
*실험목적 : 수질 시료 중에 총 인의 농도를 알아보는 실험
*실험결과
*고찰
|
- 페이지 2페이지
- 가격 1,500원
- 등록일 2015.05.19
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
므로, 25℃에서의 물의 이온곱 상수는
이 된다. 순수한 물인 경우는 [H+] = [OH-] 의 관계가 있기 때문에
이 된다. 즉 중성용액의 pH는 7이며, 그보다 수소 이온 농도가 크면 pH는 7보다 작아지고 용액은 산성이 되며, 반대로 pH가 7보다 크면 용액은
|
- 페이지 7페이지
- 가격 1,800원
- 등록일 2014.01.16
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|