
|
용해도곱 상수가 더 컸다. NaOH의 농도가 0.05M일때의 용해도곱 상수는 0.000000032이고 0.025M일 때는 0.000000032였다. 특히 용해도곱 상수는 온도에 따라서 변하기 때문에 온도를 주의해야했다. 일반화학 실험 - 용해상수의 결정
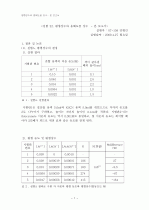
1. 실험 목적 (Pur
|
- 페이지 3페이지
- 가격 1,000원
- 등록일 2015.04.03
- 파일종류 한글(hwp)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|

|
, 여기서 완전히 녹지 않아 실험의 오차가 발생 하였던 것 같다.
9. Reference
일반화학 / MASTERTONHURLEY / 자유아카데미 / 2002 / p446~452, 560~571 1. Title
2. Date
3. Object
4. Apparatus & Reagents
5. Theory
6. Procedure
7. Data & Result
8. Discussion
9. Reference
|
- 페이지 8페이지
- 가격 2,000원
- 등록일 2010.03.09
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
용해도 및 용해도곱 상수 결정
2) 위의 결과를 토대로 용해도곱이 일정 온도에서 상수인지 확인하여라.
3) 위에서 결정된 값을 문헌 값과 비교하여라(25℃에서 5.5×10-6)
5. Question (문제)
1) 본 실험에서 사용된 각 용액에서의 Ca(OH)2의 용해
|
- 페이지 6페이지
- 가격 1,800원
- 등록일 2015.11.27
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|
|
이온과 thiocyanate이온의 착이온 생성반응을 이용해서 비색법으로 이온 농도를 추정해서 평형상수를 구했으나, 다단계의 희석이나, 육안에 의한 식별법에 의한 오차가 커서 실험이 성공적이지 못했다. 실험B에서는 수산화칼슘을 공통이온효과
|
- 페이지 7페이지
- 가격 1,200원
- 등록일 2009.10.09
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
,일진사, 2005년
-화학실험대사전(상하), 문성명, 한국사전연구사, 1992년 목차
-예비-
1. 목적
2. 원리
3. 실험 방법
4. 결과처리의 처리
5. 실험시 유의사항
6. 실험 기구와 시약
-결과-
1.실험결과
2. 결과 및 고찰
■ 참고문헌
|
- 페이지 7페이지
- 가격 1,200원
- 등록일 2005.12.05
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|